题目内容
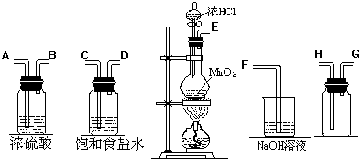
实验室用加热二氧化锰与浓盐酸的混合物制备氯气:
MnO2+4HCl(浓)一套完整的氯气实验室制备装置应该由四部分构成
(如图).同学们需要注意实验仪器的连接和作用.
A.分液漏斗:用来盛放液体试剂,本实验用来盛装浓盐酸.
B.圆底烧瓶:做反应容器,内放固体物质,本实验盛装的是固体二氧化锰.在加浓盐酸时要注意液体的量不能超过烧瓶容积的________,而且加热时要________,使烧瓶底部均匀受热,避免受热不均而炸裂.
C.除杂装置:第一个洗气瓶内盛有饱和食盐水,它的作用是除去氯气中混有的氯化氢杂质;第二个洗气瓶内盛有浓硫酸,用于除去氯气中混有的水蒸气.洗气瓶中两个导管的插入原则是“长进短出”.除杂的顺序是先除氯化氢,后除水蒸气.如果顺序颠倒,不能起到除杂的作用,原因是________.
D.集气装置:用来收集密度比空气大的气体要用向上排空气法.如果不需要收集干燥的氯气,也可以使用________的方法.
E.尾气吸收:因为氯气有毒,会污染环境,多余的氯气不能排放到大气中,选用________进行尾气处理.
答案:

练习册系列答案
相关题目
 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某化学实验小组先制取氯气,后将其溶于水制成饱和氯水,并进行了如下定性研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某化学实验小组先制取氯气,后将其溶于水制成饱和氯水,并进行了如下定性研究: 实验室制取氯气方法很多,通常有如下三种:
实验室制取氯气方法很多,通常有如下三种: