题目内容
17.下列有关电解质溶液中粒子浓度关系正确的是( )| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
分析 A.一水合氨为弱碱,弱碱在稀释过程中溶液的pH变化比强碱溶液小;
B.氯化银的溶解度大于碘化银,则氯离子浓度大于碘离子;
C.一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(NH3•H2O),结合物料守恒可得:c(NH4+)>c(Cl-)>c(NH3•H2O);
D.根据混合液中的物料守恒判断.
解答 解:A.加水稀释促进一水合氨电离,pH=a的氨水溶液,稀释10倍后,溶液中的氢氧根离子浓度大于原来的$\frac{1}{10}$,若其pH=b,则a<b+1,故A错误
B.含有AgCl和AgI固体的悬浊液,碘化银的溶解度小于氯化银,则氯离子浓度大于碘离子,溶液中离子浓度大小为:c(Ag+)>c(Cl-)>c(I-),故B错误;
C.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7),一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(NH3•H2O),结合物料守恒可得:c(NH4+)>c(Cl-)>c(NH3•H2O),所以溶液中正确的粒子浓度大小为:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-),故C错误;
D.等物质的量的NaHC2O4和Na2C2O4的溶液,根据物料守恒可得:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],故D正确;
故选D.
点评 本题考查了溶液中离子浓度大小比较、酸碱混合的定性判断等知识,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理在判断溶液中各离子浓度大小中的应用方法.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
5.下列叙述正确的是( )
| A. | 同主族元素从上到下,元素原子得电子能力逐渐减弱,表现在氢化物的稳定性逐渐增强 | |
| B. | 除稀有气体元素外,第三周期元素的原子半径不一定比第二周期元素的原子半径大 | |
| C. | 化学反应的过程中一定伴随着热量的变化 | |
| D. | 在主族元素中,最外层电子数少的元素原于一定比最外层电子数多的元素原子失电子能力强 |
12.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A. | 离子半径:r(Y2-)>r(Z2+) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | Y的气态简单氢化物的热稳定性比氮元素的气态简单氢化物弱 | |
| D. | X、Y、Z、W所有元素的最高正价等于其所在族的族序数 |
2.下列各组物质中,不是按 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | Fe | H2SO4 | Al(OH)3 | HNO3 |
| b | FeCl3 | SO2 | Na[Al(OH)4] | NO |
| c | FeCl2 | SO3 | Al2O3 | NO2 |
| A. | A | B. | B | C. | C | D. | D |
6.某有机物在O2中充分燃烧生成CO2和H2O的物质的量之比为1:2,由此可得出的结论是( )
| A. | 该有机物分子中C、H、O原子个数比为1:4:1 | |
| B. | 该有机物分子中C、H原子个数比为1:4 | |
| C. | 该有机物中必定含有氧元素 | |
| D. | 该有机物化学式为CH4O |
7.如表是元素周期表的一部分,请回答有关问题(用化学用语答题):
(1)表中金属性最强的元素,其原子结构示意图为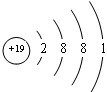 .
.
(2)表中某元素能形成两性氢氧化物,写出该两性氢氧化物与⑨的最高价氧化物的水化物反应的离子方程式(OH)3+OH-=AlO2-+2H2O.
(3)④元素与③元素形成化合物的电子式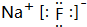 .
.
(4)下列说法正确的是E
A.元素④比⑤的金属性强,是因为④在反应中失去的电子数比⑤少
B.③、⑥、⑦三种元素中,③的最高价氧化物的水化物的酸性最强
C.⑦的氢化物的水溶液酸性比⑥强,说明元素⑦的非金属性强
D.晶体⑧在熔化过程中需破坏化学键
E.元素⑦可用于制有机农药,但其难降解、高残留,现在已逐渐被其他农药取代.
(5)⑦元素与⑩元素两者核电荷数之差是18.
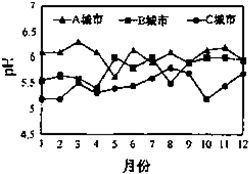
(6)汽车尾气中含有①、②元素的氧化物等有害气体,他们也是造成酸雨危害的主要原因之一.A、B、C三城市全年雨水的月平均pH变化如图2所示,
①受酸雨危害最严重的是:C城市;
②写出由元素②的一种红棕色气体形成酸雨的离子方程式:3NO2+H2O=2H++2NO3-+NO;
③汽车安装尾气催化净化装置,可将上述混合气体转化为无害气体排放,降低对环境的污染.写出该反应的化学方程式2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.催化剂的作用是:加快反应速率.
| 1 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中某元素能形成两性氢氧化物,写出该两性氢氧化物与⑨的最高价氧化物的水化物反应的离子方程式(OH)3+OH-=AlO2-+2H2O.
(3)④元素与③元素形成化合物的电子式
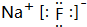 .
.(4)下列说法正确的是E
A.元素④比⑤的金属性强,是因为④在反应中失去的电子数比⑤少
B.③、⑥、⑦三种元素中,③的最高价氧化物的水化物的酸性最强
C.⑦的氢化物的水溶液酸性比⑥强,说明元素⑦的非金属性强
D.晶体⑧在熔化过程中需破坏化学键
E.元素⑦可用于制有机农药,但其难降解、高残留,现在已逐渐被其他农药取代.
(5)⑦元素与⑩元素两者核电荷数之差是18.
(6)汽车尾气中含有①、②元素的氧化物等有害气体,他们也是造成酸雨危害的主要原因之一.A、B、C三城市全年雨水的月平均pH变化如图2所示,
①受酸雨危害最严重的是:C城市;
②写出由元素②的一种红棕色气体形成酸雨的离子方程式:3NO2+H2O=2H++2NO3-+NO;
③汽车安装尾气催化净化装置,可将上述混合气体转化为无害气体排放,降低对环境的污染.写出该反应的化学方程式2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.催化剂的作用是:加快反应速率.

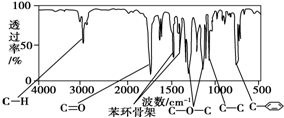 化合物A经李比希法测得其 中含C 72.0%、H 6.67%,其余含有氧;质谱法分析得知A的相对分子质量为150.现代仪器分析有机化合物的分子结构有以下两种方法.
化合物A经李比希法测得其 中含C 72.0%、H 6.67%,其余含有氧;质谱法分析得知A的相对分子质量为150.现代仪器分析有机化合物的分子结构有以下两种方法.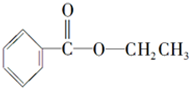 、
、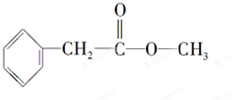 ;
; .
.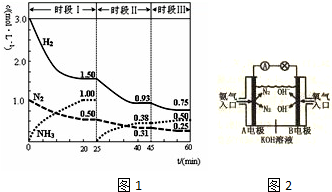
 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答: