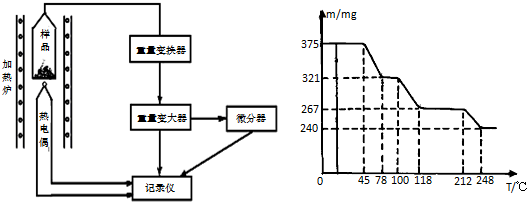
题目内容
15.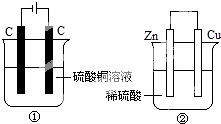 如图两个装置中,分别装有200mL对应的饱和溶液,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,分别装有200mL对应的饱和溶液,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | ②中负极:2H++2e-═H2↑ | |
| D. | 溶液的pH变化:①减小,②增大 |
分析 根据电池的工作原理写出电极反应,在两极上,得失电子数相等,可以根据电子守恒来进行相关的计算.
解答 解:A、①是电解池,电极反应为:阳极:4OH-→O2↑+2H2O+4e-,阴极:Cu2++2e-→Cu,②是原电池,正极反应:2H++2e-→H2,负极反应:Zn+2e-→Zn2+,液体体积均为200mL,当有0.02mol的电子通过时,①产生的气体是氧气,为0.005mol,②中0.01mol氢气放出,所以①<②,故A错误;
B、①中阴极反应:Cu2++2e-→Cu,阴极质量增加,②中正极反应:2H++2e-→H2,正极质量不变,故B错误;
C、电极反应式②中负极:Zn-2e-→Zn2+,故C错误;
D、溶液的pH变化:①中消耗氢氧根,所以碱性减弱pH减小,②中消耗氢离子,所以酸性减弱pH增大,故D正确.
故选D.
点评 本题考查学生原电池和电解池的工作原理以经济电极反应的书写知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
6.下列溶液中,必须通过焰色反应才能鉴别的一组是( )
| A. | Na2CO3 KCl | B. | NaCl KCl | C. | CaCl2 NaCl | D. | K2CO3 CaCl2 |
6.要除去下列各物质里的少量杂质(括号内为杂质),请按要求写出所用试剂的化学式,并在下面操作方法中选择恰当方法的编号填入表中.可供选择的操作方法:①过滤 ②洗气 ③分液 ④蒸发 ⑤蒸馏
| NO(NO2) | NH4Cl(AlCl3) | FeCl2(FeCl3) | NaNO3(NH4NO3) | |
| 所选试剂化学式 | ||||
| 操作方法编号 |
 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)(△H<0)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)(△H<0)
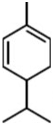 α-非兰烃是从薄荷油中得到的一种烃,其结构简式如图,α-非兰烃的分子式为C10H16,它与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构.)
α-非兰烃是从薄荷油中得到的一种烃,其结构简式如图,α-非兰烃的分子式为C10H16,它与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构.)