题目内容
【题目】某化学兴趣小组的同学用如下图所示装置研究有关电化学的问题。当闭合K时,观察到电流表的指针发生了偏移。
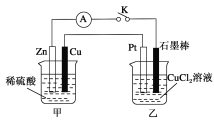
请回答下列问题:
(1)乙装置的名称是________;Zn为________极。
(2)写出电极反应:Cu极:______________________;石墨棒极:______________________。
(3)当甲中产生0.1mol气体时,乙中产生的气体在标准状况下的体积应为________________。
(4)若乙中溶液不变,将其电极都换成铜电极,闭合K一段时间后,乙中溶液的颜色________(填“变深”、“变浅”或“无变化”)。
(5)若乙中电极不变,将其溶液换成NaCl溶液,闭合K一段时间后,甲中溶液的pH将________(填“增大”、“减小”或“不变”,下同);乙中溶液的pH将________。
(6)若乙中电极不变,将其溶液换成饱和Na2SO4溶液,闭合K一段时间,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O析出,假设温度不变,剩余溶液中溶质的质量分数应为________(用含w、a的表达式表示,不必化简)。
【答案】电解池 负 2H++2e-=H2↑ Cu2++2e-=Cu 2.24L 无变化 增大 增大 ![]() ×100%
×100%
【解析】
在甲池中,有自发的氧化还原反应Zn+2H+=Zn2++H2↑,因此甲池为原电池,而乙为电解池,在甲池中,Zn失去电子,被氧化,作负极,电极方程式为Zn-2e-=Zn2+;Cu作正极,溶液中的H+得到电子,生成H2,电极方程式为2H++2e-=H2↑。乙池中,石墨与Zn相连,则石墨作阴极,溶液中的Cu2+得电子生成Cu,电极方程式为Cu2++2e-=Cu;Pt,惰性电极,与Cu相连,作阳极,溶液中的Cl-失电子,电极方程式为2Cl--2e-=Cl2↑。
(1) 在甲池中,有自发的氧化还原反应Zn+2H+=Zn2++H2↑,因此甲池为原电池,而乙为电解池,在甲池中,Zn失去电子,被氧化,作负极;
(2)根据分析,在甲池中,Zn失去电子,被氧化,作负极,电极方程式为Zn-2e-=Zn2+;Cu作正极,溶液中的H+得到电子,生成H2,电极方程式为2H++2e-=H2↑;
(3)当甲中产生了0.1mol气体,即0.1molH2,根据电极方程式,生成0.1molH2转移了0.2mol电子,则乙中,也转移0.2mol电子,生成0.1mol氯气,在标准状况下的体积为2.24L;
(4)若乙中溶液不变,将其电极都换成铜电极,Cu为活性电极,则阳极反应变为Cu-2e-=Cu2+,而阴极仍为Cu2++2e-=Cu,阳极产生的Cu2+和阴极消耗的Cu2+相等,则溶液中的Cu2+浓度不变,溶液的颜色不变;
(5)甲中消耗了H+,pH增大;电解NaCl溶液,则阴极为水得到电子,电极方程式为2H2O+2e-=H2↑+2OH-,乙中生成了OH-,pH增大;
(6)电解饱和Na2SO4溶液,Na+和SO42-均不放电,实质为电解水,阴极上有amol气体生成式,同时有w g Na2SO4·10H2O析出,假设温度不变,由于电解的是饱和Na2SO4溶液,则剩余的溶液是饱和溶液,电解消耗的水和析出的晶体,也能构成Na2SO4的饱和溶液,则可以根据析出的晶体和电解消耗的水,求解饱和Na2O4溶液中溶质的质量分数,阴极生成的为H2,根据总反应方程式2H2O![]() 2H2↑+O2↑;阴极生成amolH2,则电解了amolH2O,则析出的物质的总质量为(w+18a)g,溶质Na2SO4的质量为
2H2↑+O2↑;阴极生成amolH2,则电解了amolH2O,则析出的物质的总质量为(w+18a)g,溶质Na2SO4的质量为![]() ,则溶质的质量分数应为
,则溶质的质量分数应为![]() 。
。

 名校课堂系列答案
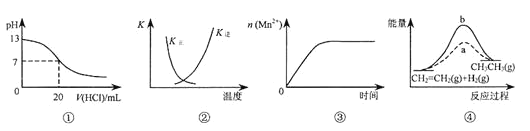
名校课堂系列答案【题目】某温度下,反应CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数K=2.25,该温度下,在体积均为10L的三个密闭容器中分别加入反应物,起始加入量如表所示,下列判断不正确的是
起始量 | 甲 | 乙 | 丙 |
H2(mol) | 1 | 2 | 2 |
CO2(mol) | 1 | 1 | 2 |
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C.平衡时,乙中H2的转化率大于60%
D.平衡时,丙中c(H2)是0.08mol/L
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量