��Ŀ����
�����仯�����ڹ�ũҵ�����о�����Ҫ���á�
��1��ijС����й�ҵ�ϳɰ�N2(g)��3H2(g)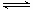 2NH3(g)
��H��0��ģ���о�����1L�ܱ������У��ֱ����0.1mol
N2��0.3mol H2��ʵ��١��ڡ�����c��N2����ʱ�䣨t���ı仯��ͼ��ʾ��
2NH3(g)
��H��0��ģ���о�����1L�ܱ������У��ֱ����0.1mol
N2��0.3mol H2��ʵ��١��ڡ�����c��N2����ʱ�䣨t���ı仯��ͼ��ʾ��
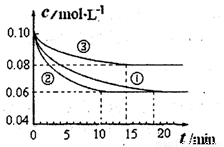
ʵ��ڴӿ�ʼ���ﵽƽ��״̬�Ĺ����У���H2��ʾ��ƽ����Ӧ����Ϊ ����ʵ�����ȣ���ʵ��������õ�ʵ����������Ϊ ������ĸ����ʵ��������õ�ʵ����������Ϊ ������ĸ����
a������ѹǿb����Сѹǿc�������¶�d�������¶�e��ʹ�ô���
��2��NH3�����ڴ��������еĵ�������䷴Ӧԭ��Ϊ2NH3(g)��NO(g)��NO2(g)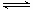 2N2(g)��3H2O(g) ��H��0����߷����е��������ת���ʣ��ɲ�ȡ�Ĵ�ʩ��
������ĸ��
2N2(g)��3H2O(g) ��H��0����߷����е��������ת���ʣ��ɲ�ȡ�Ĵ�ʩ��
������ĸ��
a�������¶� b������ѹǿ c������NH3��Ũ��
��3��NCl3��ˮ����ˮ�ⷴӦ������NH3��ͬʱ�õ� ���ѧʽ����ClO2�ǹ���Ч���������Ʊ�ԭ��ΪNCl3��6ClO2����3H2O=NH3����6ClO2��3OH����3Cl������ת��1mol���ӣ�����ȡClO2������Ϊ ��
��4��25��ʱ����amol��L-1�İ�ˮ��bmol��L-1����������ϣ���Ӧ����Һǡ�������ԣ���a b�����������������=��������a��b��ʾNH3��H2O�ĵ���ƽ�ⳣ��Ϊ ��
��12�֣���1��0.012mol/��L•min����2�֣� e��1�֣� c��1�֣� ��2��c��2�֣�
��3��HClO��1�֣� 67.5��2�֣� ��4������1�֣� 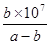 mol/L��2�֣�
mol/L��2�֣�
��������
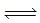
�����������1������ͼ���֪��ʵ����з�Ӧ���е�10min����ƽ��״̬��ƽ��ʱ���������ʵ���Ũ�ȼ����ˣ�0.1mol/L��0.06mol/L��0.04mol/L�����ݷ���ʽ��֪��������Ũ�ȱ仯����c��H2����3��c��N2����3��0.04mol/L��0.12mol/L�����Ԧ�(H2)�� ��0.012mol/��L•min��������ͼ���֪����ʵ�����ȣ�ʵ��ڵ���ƽ������ʱ��Ƚ϶̣���Ӧ���ʽϿ죬��ƽ��ʱ������Ũ�Ȳ��䣬���ı�����ƽ�ⲻ�ƶ������ڸ÷�Ӧ����Ӧ�����������С�ķ�Ӧ����ʵ��ڵ�����Ӧ��ʹ���˴�������ѡe������ͼ���֪����ʵ�����ȣ�ʵ��۵���ƽ������ʱ��Ҳ�Ƚ϶̣���Ӧ���ʽϿ죬��ƽ��ʱ������Ũ��������˵���ı����ƽ�����淴Ӧ�ƶ������ڸ÷�Ӧ����Ӧ�������С�ķ��ȷ�Ӧ�����ʵ��������õ�ʵ�������������¶ȣ���ѡc��
��0.012mol/��L•min��������ͼ���֪����ʵ�����ȣ�ʵ��ڵ���ƽ������ʱ��Ƚ϶̣���Ӧ���ʽϿ죬��ƽ��ʱ������Ũ�Ȳ��䣬���ı�����ƽ�ⲻ�ƶ������ڸ÷�Ӧ����Ӧ�����������С�ķ�Ӧ����ʵ��ڵ�����Ӧ��ʹ���˴�������ѡe������ͼ���֪����ʵ�����ȣ�ʵ��۵���ƽ������ʱ��Ҳ�Ƚ϶̣���Ӧ���ʽϿ죬��ƽ��ʱ������Ũ��������˵���ı����ƽ�����淴Ӧ�ƶ������ڸ÷�Ӧ����Ӧ�������С�ķ��ȷ�Ӧ�����ʵ��������õ�ʵ�������������¶ȣ���ѡc��
��2����߷����е��������ת���ʣ�Ӧ�ı�����ʹƽ��������Ӧ�ƶ�����
a���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�ƶ������������ת���ʽ��ͣ���a����
b���÷�Ӧ����Ӧ���������ķ�Ӧ������ѹǿ��ƽ�����淴Ӧ�ƶ������������ת���ʽ��ͣ���b����c������NH3��Ũ�ȣ�ƽ��������Ӧ�ƶ������������ת��������c��ȷ����ѡc��
��3��NCl3��ˮ����ˮ�ⷴӦ����NH3����˵��NCl3�����и���ԭ�ӽ��ˮ�����H�����������ԭ�ӽ��ˮ�����OH������������NH3��ͬʱ���õ�HClO����Ӧ��ֻ����Ԫ�صĻ��ϼ۷����仯����Ԫ ����NCl3��+1����ΪCl����-1�ۣ��õ����ӣ���ClO2����+3������ΪClO2��+4�ۣ�ʧȥ1�����ӣ���ÿ����1molClO2����Ӧ�о�ת��1mol���ӡ����Ե�ת��1mol����ʱ������ClO2�����ʵ���Ϊ1mol������Ϊ1mol��67.5g/mol��67.5g��
��4����Һ�����ԣ�����c(H+)��c(OH-)��������Һ�ĵ���غ�ɵã�c(H+)+c(NH4+)��c(Cl-)+ c(OH-)�����c��NH4+����c��Cl-�����Ȼ����ǿ�������Σ�NH4��ˮ�⣬��ˮ��Һ�����ԣ����Ҫʹ�Ȼ����Һ�����ԣ���ˮӦ����������Ϊ����Ͱ�ˮ�������ȣ���ˮ�����ʵ���Ũ�ȴ������ᣬ��a��b����Һ��c(H+)��c(OH-)��10-7mol/L��c(NH4+)��c(Cl-)��0.5bmol/L������c(NH3•H2O)��0.5amol/L��0.5bmol/L�����볣��ֻ���¶��йأ����ʱNH3•H2O�ĵ��볣��Kb�� ��
��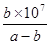 mol/L.��
mol/L.��
���㣺���鷴Ӧ���ʵļ��㡢��������Է�Ӧ���ʺ�ƽ��״̬��Ӱ�죻������ԭ��Ӧ���йؼ��㣻��Һ����Ե��ж��Լ����볣���ļ����

 ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д� 2NH3��g��
2NH3��g��


 2NH3��g������H��0���仯ѧƽ�ⳣ��K��t�Ĺ�ϵ���±�������֪K=
2NH3��g������H��0���仯ѧƽ�ⳣ��K��t�Ĺ�ϵ���±�������֪K=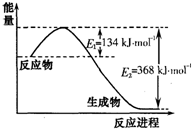 ���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ش��������⣺
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ش��������⣺