题目内容
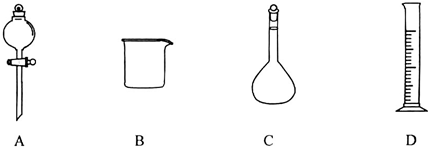
(1)用密度为1.84g?mL-1的浓硫酸配制1mol?L-1的稀硫酸时,在如下图所示的仪器中,肯定不需要的仪器是
(2)已知:25℃时,Ksp[Mg(OH)2]=5.6×10-12Ksp(MgF2)=7.4×10-11.25℃时,在氢氧化镁的悬浊液中加入少量的NH4Cl固体,c(Mg2+)
(3)加热下列各饱和溶液,蒸发部分溶剂,能析出得到原溶液中溶质的是
a.KNO3溶液 b.AlCl3溶液 c.CuSO4溶液.
A
A
(填序号),配制上述溶液还需要另外配备的玻璃仪器是胶头滴管
胶头滴管
、玻璃棒
玻璃棒
(填仪器名称).
(2)已知:25℃时,Ksp[Mg(OH)2]=5.6×10-12Ksp(MgF2)=7.4×10-11.25℃时,在氢氧化镁的悬浊液中加入少量的NH4Cl固体,c(Mg2+)
增大
增大
(填“增大”“减小”或“不变”);在等浓度的KOH和KF混合溶液中加入稀MgCl2的溶液,首先生成的沉淀是Mg(OH)2
Mg(OH)2
(写化学式).(3)加热下列各饱和溶液,蒸发部分溶剂,能析出得到原溶液中溶质的是
a
a
(填序号);a.KNO3溶液 b.AlCl3溶液 c.CuSO4溶液.
分析:(1)根据配制溶液的实验操作过程选择所用仪器;
(2)加入氯化铵溶液,铵根离子结合氢氧根离子,促进氢氧化镁溶解;
氢氧化镁与氟化镁,结构相同,溶度积越小越先沉淀;
(3)氯化铝溶液,加热促进氯化铝水解,会析出氢氧化铝.硫酸铜溶液加热蒸发,析出硫酸铜晶体.
(2)加入氯化铵溶液,铵根离子结合氢氧根离子,促进氢氧化镁溶解;
氢氧化镁与氟化镁,结构相同,溶度积越小越先沉淀;
(3)氯化铝溶液,加热促进氯化铝水解,会析出氢氧化铝.硫酸铜溶液加热蒸发,析出硫酸铜晶体.
解答:解:(1)操作步骤有计算、量取、稀释、冷却、移液、洗涤移液、定容、摇匀等操作,量筒量取浓硫酸(用到胶头滴管),在烧杯中溶解(可用量筒加水),用玻璃棒搅拌,加速溶解,恢复到室温后转移到容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所用仪器有:量筒、容量瓶、烧杯、玻璃棒、胶头滴管等,
肯定不需要的是:分液漏斗;还需用到的玻璃仪器是:胶头滴管、玻璃棒.
故答案为:A;胶头滴管、玻璃棒;
(2)加入氯化铵溶液,铵根离子结合氢氧根离子,促进氢氧化镁溶解,溶液c(Mg2+)增大;
氢氧化镁与氟化镁,结构相同,Mg(OH)2的溶度积更小,故先析出Mg(OH)2,
故答案为:增大;Mg(OH)2;
(3)a.热蒸发KNO3溶液饱和溶液,析出硝酸钾,故a符合;
b.加热蒸发AlCl3饱和溶液,加热促进氯化铝水解,会析出氢氧化铝,故b不符合;
c.加热蒸发CuSO4饱和溶液,析出硫酸铜晶体,故c不符合;
故答案为:a.
所用仪器有:量筒、容量瓶、烧杯、玻璃棒、胶头滴管等,
肯定不需要的是:分液漏斗;还需用到的玻璃仪器是:胶头滴管、玻璃棒.
故答案为:A;胶头滴管、玻璃棒;
(2)加入氯化铵溶液,铵根离子结合氢氧根离子,促进氢氧化镁溶解,溶液c(Mg2+)增大;
氢氧化镁与氟化镁,结构相同,Mg(OH)2的溶度积更小,故先析出Mg(OH)2,
故答案为:增大;Mg(OH)2;
(3)a.热蒸发KNO3溶液饱和溶液,析出硝酸钾,故a符合;
b.加热蒸发AlCl3饱和溶液,加热促进氯化铝水解,会析出氢氧化铝,故b不符合;
c.加热蒸发CuSO4饱和溶液,析出硫酸铜晶体,故c不符合;
故答案为:a.
点评:本题考查一定物质的量浓度溶液配制、溶解平衡、溶度积等,难度不大,注意基础知识的理解掌握.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
(8分)某实验小组设计用50 mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在下图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
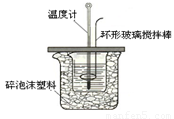
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热
数值 (填偏高、偏低或不变);
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
|
实验序号 |
起始温度t1/℃[来源:Zxxk.Com][来源:Z.xx.k.Com] |
终止温度(t2)℃[来源:Z.xx.k.Com] |
温差(t2-t1)℃ |
||
|
盐酸 |
NaOH溶液 |
平均值 |
|||
|
1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
|
2 |
25.1 |
25.1 |
25.1 |
31.8 |
6.7 |
|
3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18J(g.·℃)则该反应的中和热为△H=___________________________________;
(3)若用浓硫酸与NaOH溶液反应,则测得的中和热的数值会 (填偏高、偏低或不变),其原因是 ;







