题目内容
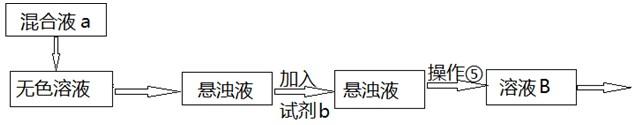
(8分)某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
Ⅰ.①配制浓度均为0.5 mol/L 的H2SO4和H2C2O4溶液。
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端。
④检查装置的气密性,在广口瓶中装满水,按图连接好装置。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 。
⑥反应结束后,读取量筒内水的体积为 y mL。
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管。
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 。
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 。
(4)简述速率不等的原因 ,
铜丝不与酸接触的原因 。
Ⅰ.酸式滴定管 反应所需时间
Ⅱ.(1)250 mL的容量瓶 胶头滴管 (2)②①③
(3)下移丙 (4)氢离子浓度不同 易形成原电池加快反应速率,干扰实验的测定
【解析】

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(本题共16分)某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
[实验设计]
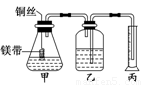
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有: 。
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀。请从所提供的试剂或电极材料中选择正确的序号填在横线上:
①纯水 ②NaCl溶液 ③NaOH溶液 ④四氯化碳 ⑤CuCl2溶液 ⑥乙醇 ⑦Fe棒 ⑧植物油 ⑨碳棒
a为___________,b为___________,c为___________,d为___________。(填序号)
[探究思考]实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色Fe(OH)3。这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+。 |
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2·nH2O所致。用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势。
加热时,“方法一”中弹簧夹C应处于___________(填“打开”或“关闭”)状态,容器A中的反应须处于___________(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式_______________。
(3)欢迎你参加该研究小组的讨论,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路。 。
(本题共16分)某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:

[实验设计]
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有: 。
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀。请从所提供的试剂或电极材料中选择正确的序号填在横线上:
①纯水 ②NaCl溶液 ③NaOH溶液 ④四氯化碳 ⑤CuCl2溶液 ⑥乙醇 ⑦Fe棒 ⑧植物油 ⑨碳棒
a为___________,b为___________,c为___________,d为___________。(填序号)
[探究思考]实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
|
资料名称 |
物理性质描述 |
化学性质描述 |
|
《化学辞典》,顾翼东编,1989年版P637 |
白色无定形粉末或白色至淡绿色六方晶体 |
与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
|
《大学普通化学(下册)》傅鹰著P637 |
白色沉淀 |
此沉淀易被氧化成微绿色Fe3(OH)8 |
|
《普通化学教程》(下册)P788 |
白色 |
能强烈吸收O2,迅速变成棕色Fe(OH)3。这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+。 |
阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:__________ ;资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成__________________。
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2·nH2O所致。用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势。
加热时,“方法一”中弹簧夹C应处于___________(填“打开”或“关闭”)状态,容器A中的反应须处于___________(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式_______________。
(3)欢迎你参加该研究小组的讨论,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路。 。
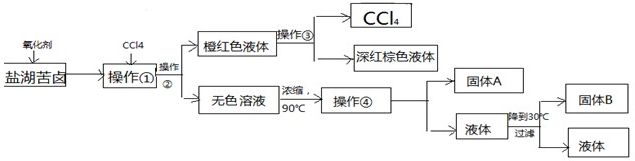
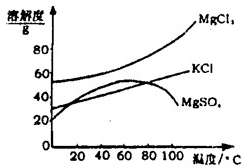 请根据以上流程,回答相关问题:
请根据以上流程,回答相关问题: