��Ŀ����
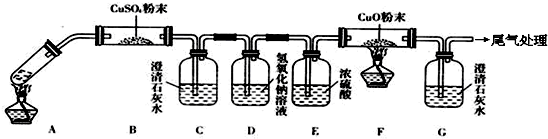
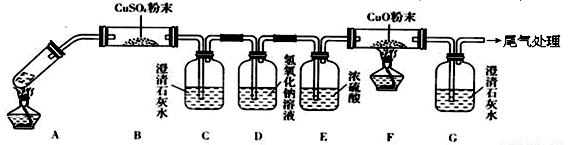
�о���ѧϰС��������ϵ�֪��Ư�������ᷴӦ�����Ƶ���������ѧ����ʽΪ��Ca��ClO��2+CaCl2+2H2SO4 2CaSO4+2Cl2��+2H2O�����������������ȡ��������֤�����ʵ�ʵ�飮
2CaSO4+2Cl2��+2H2O�����������������ȡ��������֤�����ʵ�ʵ�飮
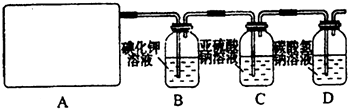
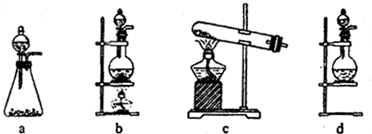
�Իش𣺣�1����ʵ����A���ֵ�װ����______����дװ�õ���ţ���

��2����1��ѡ����dװ�õ�������Ҫ�IJ�����������Ʒֱ���______��______��
��3���������һ��ʵ�飬֤��ϴ��ƿC�е�Na2SO3�Ѿ�������������ʵ�鲽�裩��______��
��4���ֱ�д��Cװ�á�Dװ�÷�����Ӧ�����ӷ���ʽ______��
��5����ʵ��������Ե�ȱ�ݣ�����ӻ�ѧ��Ӧ���ӽ�����Ľ��ķ�����______����������Ӧ�Ļ�ѧ����ʽ��______��
��6����С���ֽ���������ʵ�飺��ȡƯ��2.0g����ĥ���ܽ⣬���Ƴ�250mL��Һ��ȡ25mL���뵽��ƿ�У��ټ��������KI��Һ������H2SO4��Һ�����ã�����ȫ��Ӧ����0.1mol/L��Na2S2O3��Һ������Һ�ζ���Ӧ���ɵĵ⣬��֪��Ӧ����ʽΪ��
2Na2S2O3+I2�TNa2S4O6+2NaI ��Ӧ���ʱ������ȥNa2S2O3 20.0mL�����Ư����Ca��ClO��2����������Ϊ______����������0.01%��
�⣺��1��A����������ȡCl2����������Cl2�����ɷ�Ӧ�ķ�Ӧ��״̬�ͷ�Ӧ�Ƿ���Ҫ����ѡ�����巢��װ�ã�Ӧѡ���ڡ���+Һ �����͵�b���ʴ�Ϊ��b��
�����͵�b���ʴ�Ϊ��b��
��2��dװ�õ�������Ҫ�IJ�������ΪԲ����ƿ�ͷ�Һ©�����ʴ�Ϊ����Һ©����Բ����ƿ��
��3��Na2SO3�����IJ���ΪNa2SO4��ȷ������SO42-����֤��Na2SO3�Ѳ��ֱ�����������ʱ��ӦȡC����Һ�����ڽྻ�Թ��У��ȼ�ϡHCl�����ٲ����������ų�SO32-�ĸ��ţ�Ȼ���ټ���BaCl2��Һ����������ɫ��������֤��Na2SO3�Ѳ��ֱ�������
�ʴ�Ϊ��ȡ������Һ���ڽྻ���Թ��У������еμ�ϡ���������ٲ������壬�������е����Ȼ�����Һ����������ɫ������֤���������Ʊ�������
��4��Cװ����������ͨ������������Һ�з����ķ�Ӧ���������ƾ��л�ԭ�Ա���������Ϊ�����ƣ���Ӧ�����ַ���ʽΪ��Cl2+H2O+SO32��=SO42��+2Cl��+2H+������D��Cl2��ˮ��Ӧ�����ӷ���ʽΪCl2+H2O?H++Cl-+HClO��HCl����NaHCO3��Ӧ�����ӷ���ʽΪH++HCO3-=CO2��+H2O��HClO�����Ա�H2CO3����������NaHCO3��Ӧ��Cl2+H2O�TH++Cl-+HClO��H++HCO3-�TCO2��+H2O����HCO3��+Cl2=HClO+CO2��+Cl-��
�ʴ�Ϊ��Cl2+H2O+SO32��=SO42��+2Cl��+2H+��Cl2+H2O�TH++Cl-+HClO��H++HCO3-�TCO2��+H2O����HCO3��+Cl2=HClO+CO2��+Cl-��
��5��NaHCO3����Cl2���������ޣ���Dװ�ú�����һ��β������װ�ã�Ӧ��β��ͨ��NaOH��Һ�У���Ӧ�Ļ�ѧ����ʽΪ��Cl2+2NaOH=NaCl+NaClO+H2O��
�ʴ�Ϊ����Dװ�ú�����һ��β������װ�ã�Ӧ��β��ͨ��NaOH��Һ�У�Cl2+2NaOH=NaCl+NaClO+H2O��
��5����ϵʽCa��ClO��2��2Cl2��2I2��4Na2S2O3��
n[Ca��ClO��2]=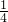 n��Na2S2O3��=20.0 mL��10-3 L?mL-1��0.1 mol?L-1��
n��Na2S2O3��=20.0 mL��10-3 L?mL-1��0.1 mol?L-1��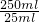 =0.005 mol��
=0.005 mol��
Ca��ClO��2%= ��100%=35.75%��
��100%=35.75%��
�ʴ�Ϊ��35.75%��
��������1�����ݷ�Ӧ���״̬����Ӧ����ѡ����װ�ã�
��2������dװ�������ش�
��3��������ǿ�����ԣ�������������л�ԭ�ԣ�����������������������ܷ���������ԭ��Ӧ������������ӡ������Ӻ������ӣ�����������Ʊ����������������ƣ�������������ӵļ��鷽�����鼴�ɣ�
��4��cװ��������������������ӷ���������ԭ��Ӧ��������������Ӻ������ӣ�dװ����������ˮ��Ӧ��������ʹ����ᣬ�����ܺ�̼��������ӷ�Ӧ���ɶ�����̼��
��5�������д̼�����ζ��β������ֱ���ſգ�Ҫ��β������װ�ô�����
��6�������û�ѧ��Ӧ�Ķ�����ϵʽ����Na2S2O3��Ca��ClO��2�Ķ�����ϵ����õ���
���������⿼���Ϊ�ۺϣ���Ӧװ��ѡ�����ʼ��鷽���ͷ�Ӧ���ӷ���ʽ����д��ע������������ӵļ�������Ҫ�ų���������ӵĸ��ţ��״���Ϊ��6����ע����ݹ�ϵʽ�����㣬��Ŀ�Ѷ��еȣ�
 �����͵�b���ʴ�Ϊ��b��
�����͵�b���ʴ�Ϊ��b����2��dװ�õ�������Ҫ�IJ�������ΪԲ����ƿ�ͷ�Һ©�����ʴ�Ϊ����Һ©����Բ����ƿ��
��3��Na2SO3�����IJ���ΪNa2SO4��ȷ������SO42-����֤��Na2SO3�Ѳ��ֱ�����������ʱ��ӦȡC����Һ�����ڽྻ�Թ��У��ȼ�ϡHCl�����ٲ����������ų�SO32-�ĸ��ţ�Ȼ���ټ���BaCl2��Һ����������ɫ��������֤��Na2SO3�Ѳ��ֱ�������
�ʴ�Ϊ��ȡ������Һ���ڽྻ���Թ��У������еμ�ϡ���������ٲ������壬�������е����Ȼ�����Һ����������ɫ������֤���������Ʊ�������
��4��Cװ����������ͨ������������Һ�з����ķ�Ӧ���������ƾ��л�ԭ�Ա���������Ϊ�����ƣ���Ӧ�����ַ���ʽΪ��Cl2+H2O+SO32��=SO42��+2Cl��+2H+������D��Cl2��ˮ��Ӧ�����ӷ���ʽΪCl2+H2O?H++Cl-+HClO��HCl����NaHCO3��Ӧ�����ӷ���ʽΪH++HCO3-=CO2��+H2O��HClO�����Ա�H2CO3����������NaHCO3��Ӧ��Cl2+H2O�TH++Cl-+HClO��H++HCO3-�TCO2��+H2O����HCO3��+Cl2=HClO+CO2��+Cl-��
�ʴ�Ϊ��Cl2+H2O+SO32��=SO42��+2Cl��+2H+��Cl2+H2O�TH++Cl-+HClO��H++HCO3-�TCO2��+H2O����HCO3��+Cl2=HClO+CO2��+Cl-��
��5��NaHCO3����Cl2���������ޣ���Dװ�ú�����һ��β������װ�ã�Ӧ��β��ͨ��NaOH��Һ�У���Ӧ�Ļ�ѧ����ʽΪ��Cl2+2NaOH=NaCl+NaClO+H2O��
�ʴ�Ϊ����Dװ�ú�����һ��β������װ�ã�Ӧ��β��ͨ��NaOH��Һ�У�Cl2+2NaOH=NaCl+NaClO+H2O��
��5����ϵʽCa��ClO��2��2Cl2��2I2��4Na2S2O3��
n[Ca��ClO��2]=
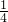 n��Na2S2O3��=20.0 mL��10-3 L?mL-1��0.1 mol?L-1��
n��Na2S2O3��=20.0 mL��10-3 L?mL-1��0.1 mol?L-1��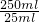 =0.005 mol��
=0.005 mol��Ca��ClO��2%=
 ��100%=35.75%��
��100%=35.75%���ʴ�Ϊ��35.75%��
��������1�����ݷ�Ӧ���״̬����Ӧ����ѡ����װ�ã�
��2������dװ�������ش�
��3��������ǿ�����ԣ�������������л�ԭ�ԣ�����������������������ܷ���������ԭ��Ӧ������������ӡ������Ӻ������ӣ�����������Ʊ����������������ƣ�������������ӵļ��鷽�����鼴�ɣ�
��4��cװ��������������������ӷ���������ԭ��Ӧ��������������Ӻ������ӣ�dװ����������ˮ��Ӧ��������ʹ����ᣬ�����ܺ�̼��������ӷ�Ӧ���ɶ�����̼��
��5�������д̼�����ζ��β������ֱ���ſգ�Ҫ��β������װ�ô�����
��6�������û�ѧ��Ӧ�Ķ�����ϵʽ����Na2S2O3��Ca��ClO��2�Ķ�����ϵ����õ���
���������⿼���Ϊ�ۺϣ���Ӧװ��ѡ�����ʼ��鷽���ͷ�Ӧ���ӷ���ʽ����д��ע������������ӵļ�������Ҫ�ų���������ӵĸ��ţ��״���Ϊ��6����ע����ݹ�ϵʽ�����㣬��Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ