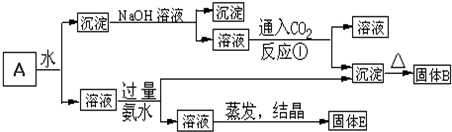
题目内容
下列说法不正确的是( )
| A、铜在潮湿的空气中不会被锈蚀 |
| B、纯铁的抗蚀性很强 |
| C、普通玻璃没有一定的熔点 |
| D、常温下,铝不被空气氧化,因而可做导线 |
考点:金属腐蚀的化学原理,玻璃的主要化学成分、生产原料及其用途
专题:金属概论与碱元素,化学应用
分析:A.铜与氧气、二氧化碳和水充分接触时容易生锈;
B.依据纯铁不能形成电化学腐蚀,生铁含有杂质碳,铁和碳在表面电解质溶液中形成原电池反应,铁做负极被腐蚀分析判断;
C.晶体有一定的熔点,非晶体没有,玻璃没有固定的熔点;
D.铝很活泼,在空气中易被氧化生成氧化铝.
B.依据纯铁不能形成电化学腐蚀,生铁含有杂质碳,铁和碳在表面电解质溶液中形成原电池反应,铁做负极被腐蚀分析判断;
C.晶体有一定的熔点,非晶体没有,玻璃没有固定的熔点;
D.铝很活泼,在空气中易被氧化生成氧化铝.
解答:
解:A.铜片长期暴露在空气中与空气中的水蒸气、氧气和二氧化碳反应,在表面会形成一层铜绿,铜绿的成分为Cu2(OH)2CO3,故A选;
B.纯铁不含杂质,不能构成原电池,在潮湿空气中生铁中含有杂质和铁与表面的电解质溶液形成原电池反应,铁做负极,生铁比纯铁容易被腐蚀,故B不选;
C.晶体熔化过程中吸热,温度保持不变;非晶体没有熔点,熔化过程中不断吸收热量,温度逐渐升高,玻璃可在一定温度范围内软化,没有固定的熔点,故C不选;
D.常温下,铝易被氧气氧化生成一层致密的氧化物薄膜而阻止进一步被氧化,所以铝具有较强的抗腐蚀性,可做导线是因为铝具有导电性,故D选;
故选AD.
B.纯铁不含杂质,不能构成原电池,在潮湿空气中生铁中含有杂质和铁与表面的电解质溶液形成原电池反应,铁做负极,生铁比纯铁容易被腐蚀,故B不选;
C.晶体熔化过程中吸热,温度保持不变;非晶体没有熔点,熔化过程中不断吸收热量,温度逐渐升高,玻璃可在一定温度范围内软化,没有固定的熔点,故C不选;
D.常温下,铝易被氧气氧化生成一层致密的氧化物薄膜而阻止进一步被氧化,所以铝具有较强的抗腐蚀性,可做导线是因为铝具有导电性,故D选;
故选AD.
点评:本题考查了元素化合物知识,掌握铜、铁、玻璃、铝的性质是解答关键,注意铝的性质,铝的氧化物薄膜致密性较强,能防止铝继续被腐蚀,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在实验室中制取纯净、干燥的氯气时,可使气体依次通过( )
| A、饱和食盐水、浓硫酸 |
| B、NaOH溶液、浓硫酸 |
| C、NaHCO3溶液、碱石灰 |
| D、浓硫酸、饱和食盐水 |
某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是( )
| A、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、c(NH4+)+c(H+)>c(Cl-)+c(OH-) |
常温下,0.1mol/L的氨水pH=11,下列叙述错误的是( )
A、向该溶液中加水稀释:
| ||
| B、0.1mol/L氨水与0.1mol/L H2SO4溶液等体积混合后所得溶液中:c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | ||
| C、0.1mol/L氨水与0.05mol/L HCl溶液等体积混合后所得溶液中:n(NH4+)+n(NH3)+n(NH3?H2O)=2n(Cl-) | ||
| D、浓度均为0.1mol/L氨水和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH3?H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能共存的是( )
| A、NH4+ NO3- CO32- Na+ |
| B、Na+ Ba2+ Mg2+ HCO3- |
| C、SO42- Na+ K+ Cl- |
| D、NO3- K+ AlO2- SO42- |
以下能级符号错误的是( )
| A、5s | B、3d | C、3f | D、6p |
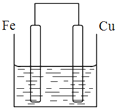 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置: