题目内容
BCl3原子的杂化方式为 .第一电离能介于B、N之间的第二周期元素有 种.写出与BCl3结构相同的一种等电子体(写离子) .
考点:原子轨道杂化方式及杂化类型判断,“等电子原理”的应用
专题:原子组成与结构专题,化学键与晶体结构
分析:根据分子中中心原子的价层电子对数判断;同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
价电子数相等、原子个数相等的微粒为等电子体.
价电子数相等、原子个数相等的微粒为等电子体.
解答:
解:BCl3中的B原子的价层电子对数是3且不含孤电子对,所以B原子属于sp2杂化;
同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;
BCl3互为等电子体的阴离子为:NO3-或CO3 2-;
故答案为:sp2;3;NO3-或CO3 2-.
同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;
BCl3互为等电子体的阴离子为:NO3-或CO3 2-;
故答案为:sp2;3;NO3-或CO3 2-.
点评:本题考查了杂化类型的判断、第一电离能、等电子体,注意把握同周期元素的第一电离能的变化趋势,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
下列说法不正确的是( )
| A、铜在潮湿的空气中不会被锈蚀 |
| B、纯铁的抗蚀性很强 |
| C、普通玻璃没有一定的熔点 |
| D、常温下,铝不被空气氧化,因而可做导线 |
下列电子式中,正确的是( )
A、 |
B、 |
C、 |
| D、:N:::N: |
根据元素的单质和化合物性质判断元素非金属性强弱的依据一般是( )
| A、元素最高价氧化物的水化物的碱性强弱 |
| B、元素最高价氧化物的水化物的酸性强弱 |
| C、元素的单质跟酸反应置换出氢气的难易 |
| D、元素的单质跟氢气反应生成气态氢化物水溶液的酸性强弱 |
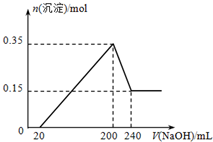 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol?L-1 NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.请通过计算回答:
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol?L-1 NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.请通过计算回答: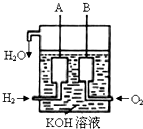 已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题: