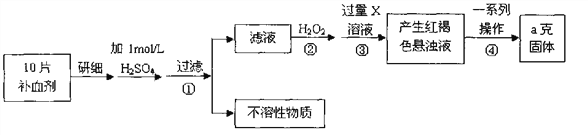
题目内容
【题目】氯气是一种重要的工业原料。
(1)写出实验室制取氯气反应的化学方程式________________________。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
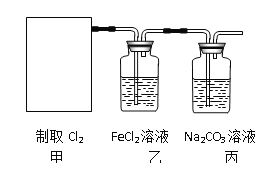
①在该实验中,甲部分的装置是_______(填字母)。

②乙装置中FeCl2溶液与Cl2反应的离子方程式是________________。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质,这种物质是_______(化学式)。
④有人认为该实验存在明显的缺陷,请你将认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的最合适的化学试剂。______________
请你写出Cl2和“④”中“最合适的化学试剂”反应的离子方程式______________。
【答案】 MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2H2O c 2Fe2++Cl2 = 2Fe3++2Cl- NaClO
MnCl2 + Cl2↑+ 2H2O c 2Fe2++Cl2 = 2Fe3++2Cl- NaClO  Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
【解析】(1)实验室制取氯气,用MnO2和浓盐酸共热制备,因此反应方程式为:MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2H2O ;(2)①甲装置制取氯气,采用MnO2和浓盐酸共热产生,因此利用固体和液体共热的装置,即c正确;②Fe2+具有还原性,氯气具有强氧化性,把Fe2+氧化成Fe3+,即离子反应方程式为2Fe2++Cl2=2Fe3++2Cl-;③Cl2+H2O=HCl+HClO,HCl+Na2CO3=NaHCO3+NaCl,HClO+Na2CO3=NaClO+NaHCO3,因此漂白性和消毒的物质为NaClO;④氯气有毒,缺少尾气处理装置,处理氯气常用NaOH,因此
MnCl2 + Cl2↑+ 2H2O ;(2)①甲装置制取氯气,采用MnO2和浓盐酸共热产生,因此利用固体和液体共热的装置,即c正确;②Fe2+具有还原性,氯气具有强氧化性,把Fe2+氧化成Fe3+,即离子反应方程式为2Fe2++Cl2=2Fe3++2Cl-;③Cl2+H2O=HCl+HClO,HCl+Na2CO3=NaHCO3+NaCl,HClO+Na2CO3=NaClO+NaHCO3,因此漂白性和消毒的物质为NaClO;④氯气有毒,缺少尾气处理装置,处理氯气常用NaOH,因此 ;发生歧化反应,Cl2+2OH-=Cl-+ClO-+H2O。
;发生歧化反应,Cl2+2OH-=Cl-+ClO-+H2O。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案