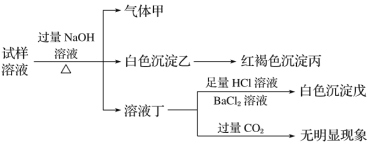
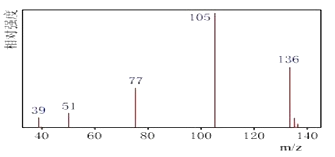
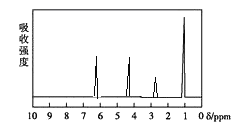
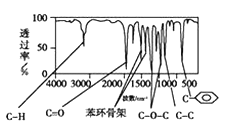
题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.22.4LCl2溶于足量水,所得溶液中Cl2、Cl-、HClO和ClO-四种微粒总数为NA
B.标准状况下,38g3H2O2中含有3NA共价键
C.常温下,将5.6g铁块投入足量浓硝酸中,转移0.3NA电子
D.标准状况下,5.6L 一氧化氮和5.6L 氧气混合后的分子总数为0.5NA
【答案】B
【解析】
A、题中没有说明条件是否是标准状况下,因此无法计算Cl2的物质的量,故A错误;
B、过氧化氢的结构式为H-O-O-H,利用质量数近似等于相对原子质量,该过氧化氢的摩尔质量为38g·mol-1,因此38g该过氧化氢中含有共价键的物质的量为![]() =3mol,故B正确;
=3mol,故B正确;
C、铁与浓硝酸发生钝化反应,阻碍反应的进行,无法计算出转移电子物质的量,故C错误;
D、标准状况下,5.6L气体的物质的量为0.25mol,NO与O2反应:2NO+O2=2NO2,根据量的关系,生成NO2的物质的量为0.25mol,剩余氧气的物质的量为0.125mol,即气体总物质的量为0.375mol,NO2气体中存在2NO2![]() N2O4,即反应后气体物质的量小于0.375mol,故D错误;
N2O4,即反应后气体物质的量小于0.375mol,故D错误;
答案为B。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反应0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1时,反应的平衡常数K1=1.2
C. 其他条件不变,9 min后,向容器中再充入1.6 molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D. 其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0