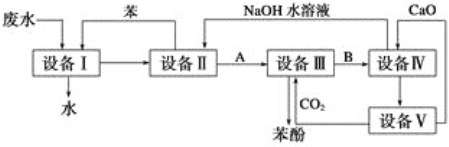
题目内容
【题目】某同学在锌与稀硫酸制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有________________________ 、 ________________________
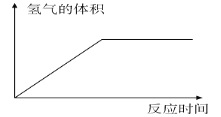
(2)下图表示一定量的锌与足量的稀硫酸反应生成氢气的关系,若在反应液中加入少量硫酸铜固体,请在下图中用虚线表示这一关系。____________________
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验,将表中的混合溶液分别加入到六个盛有过量锌粒的反应瓶中,收集产生氢气,记录获得相同体积的氢气所需的时间。
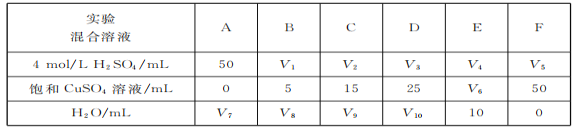
请完成此实验设计,其中:V2=_______ ,V6=_____________,V8=______________
该同学最后得出的结论为:当加入少量硫酸铜溶液时生成氢气的速率会大大提高,但当加入的硫酸铜溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因:______________________
【答案】Zn+2H+=Zn2++H2↑ Zn+Cu2+=Zn2++Cu 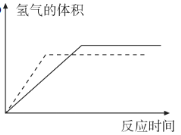 50 40 45 加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,减小了锌与硫酸溶液的接触面积
50 40 45 加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,减小了锌与硫酸溶液的接触面积
【解析】
锌与硫酸铜溶液反应生成铜单质,在稀硫酸中,锌与铜形成了原电池,加快了反应速率。
(1) 锌与硫酸铜溶液反应生成铜单质,在稀硫酸中,锌与铜形成了原电池,所以发生反应的离子方程式有Zn+2H+=Zn2++H2↑、Zn+Cu2+=Zn2++Cu;
(2) 锌与硫酸铜溶液反应消耗了锌,产生的氢气总体积减少,锌与铜在稀硫酸中形成了原电池,产生氢气的速率加快,所以图像为 ;
;
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,则六组实验中硫酸的物质的量及物质的量浓度都应该保持相同,所以V1、V2、V3、V4、V5都应该是50,根据F,溶液的总体积应该是100,所以V6=100-50-10=40,V8=100-50-5=45;
当硫酸铜溶液超过一定量时,会生成较多的铜,覆盖在锌表面,减小了锌与硫酸溶液的接触面积,所以氢气生成速率下降,即氢气生成速率下降的主要原因:加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,减小了锌与硫酸溶液的接触面积。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
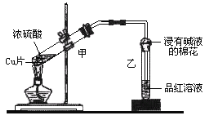
小学生10分钟应用题系列答案【题目】Ⅰ.实验室制得气体中常含有杂质,影响其性质检验。下图A为除杂装置,B为性质检验装置,完成下列表格:

序号 | 气体 | 反应原理 | A中试剂 |
① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | _________ |
② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是________________。 | NaOH溶液 |
③ | 乙炔 | 电石与饱和食盐水反应 | _________ |
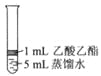
Ⅱ.为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
试管编号 | ① | ② | ③ |
实验操作 |
|
|
|
实验现象 | 酯层变薄 | 酯层消失 | 酯层基本不变 |
(1)试管①中反应的化学方程式是_____________________;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是________________;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因_______________。