题目内容
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某物质的溶液中由水电离出c(H+)=1×10—amol/L,若a>7时,则该溶液的pH一定为14-a
B.某溶液中存在的离子有S2—、HS—、OH—、Na+、H+,则离子浓度的大小关系一定是:c(Na+)>c(S2—)>c(OH—)>c(HS—)>c(H+)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2—)+c(HR—)=c(Na+)
D.将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH—)=2c(H+)+c(HA)-c(A—)
D
解析试题分析:A、某物质的溶液中由水电离出c(H+)=1×10—amol/L,若a>7时,则该溶液的pH为a或14-a,错误;B、某溶液中存在的离子有S2—、HS—、OH—、Na+、H+,溶质不能确定,浓度不确定,所以离子浓度的大小关系不能确定,错误;C、根据混合后的溶液呈中性及电荷守恒,可知
2c(R2—)+c(HR—)+c(OH-)=c(Na+)+c(H+),其中c(OH-)= c(H+),所以2c(R2—)+c(HR—)=c(Na+),错误;D、0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,说明该一元酸为弱酸,根据物料守恒规律及电荷守恒规律可得2 c(Na+)= c(A—)+ c(HA) ,c(Na+)+c(H+)= c(OH-)+ c(A—),两式结合可得2c(OH—)=2c(H+)+c(HA)-c(A—),正确,答案选D。
考点:考查电解质溶液中离子浓度大小的比较、守恒规律的应用等有关知识

 名校课堂系列答案
名校课堂系列答案现有常温下的五种溶液(如下表)。
| | ① | ② | ③ | ④ | ⑤ |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | 醋酸钠 |
| pH | 11 | 11 | 3 | 3 | 8.3 |
下列有关叙述中正确的是
A.五种溶液中,水电离出的c(OH-)最小的是⑤
B.将①、④两种溶液等体积混合,所得溶液中:c(Cl-) >c(NH4+)>c(H+)>c(OH-)
C.分别将①、②、③、④加水稀释100倍,稀释后四种溶液的pH:①>②>③>④
D.在⑤中加入适量的④至溶液呈中性,所得溶液中:c(Na+)>c(Cl-)=c(CH3COOH)
下列物质能促进水的电离的是
| A.小苏打 | B.醋酸 | C.乙醇 | D.氯化钠 |
下列液体均处于25℃,下列有关叙述正确的是( )
| A.PH值相同的盐酸和氯化铵溶液中水的电离程度相同 |
| B.某溶液中由水电离出的c(H+)=10-13,则该溶液的PH一定为13 |
| C.PH=4.5的番茄汁中c(H+)是PH=6.5的牛奶中c(H+)的2倍 |
| D.中和浓度和体积均相同的盐酸和醋酸,消耗的氢氧化钠的物质的量之比为1:1 |
欲同时对农作物施用含N、P、K三种元素的化肥,现有:①K2CO3、②KCl、③Ca(H2PO4)2、④(NH4)2SO4、⑤氨水,最适合的组合是( )。
| A.①②③ | B.②③④ | C.①③⑤ | D.②③⑤ |
25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ,滴定曲线如下图所示。下列说法正确的是( )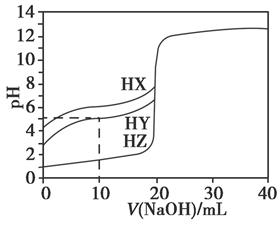
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B.根据滴定曲线,可得Ka(HY)≈10-5 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) |
D.HY与HZ混合,达到平衡时:c(H+)=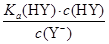 +c(Z-)+c(OH-) +c(Z-)+c(OH-) |
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)。下列说法正确的是( )
[B(OH)4]-(aq)+H+(aq)。下列说法正确的是( )
| 化学式 | 电离常数(298 K) |
| H3BO3 | K=5.7×10-10 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| CH3COOH | K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
B.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
下列有关沉淀溶解平衡的说法中,正确的是( )
| A.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 |
| B.在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动 |
| C.可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 |
| D.25 ℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成 |
