题目内容
(12分)某同学用10mol• L-1 的浓盐酸配制250mL1mol• L-1 的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸____________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有________________、___________。
(3)实验室中所用少量氯气用下列方法制取:4HCl(浓)+MnO2Cl2↑+MnCl2+2H2O。
试回答下列问题:
该反应中_____________是氧化剂,氧化产物是_______________。
若产生标准状况下的Cl22.24L,则被氧化的HCl__________mol。
(1)25 ;(2)250mL容量瓶 、胶头滴管; (3) MnO2 ;Cl2; 0.2
解析:(1)根据溶液稀释时溶质的质量不变,可计算出需要量取浓盐酸的体积为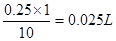 。
。
(2)根据物质的量浓度配制要求,除量筒、烧杯、玻璃棒外,还必须用到的仪器是250mL容量瓶 和胶头滴管。
(3)由方程式可知MnO2中Mn元素的化合价由+4价降低到+2价,被还原,作氧化剂,MnCl2是还原产物;HCl中Cl的化合价由-1价升高到0价,被氧化,作还原剂,Cl2是氧化产物。但4molHCl只有2mol作还原剂,另外2mol其酸性的作用。标准状况下的Cl2 是2.24L,其物质的量是0.1mol,根据原子守恒知被氧化的HCl的物质的量是0.2mol。

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目