题目内容
18.写出相应反应的方程式(注明条件)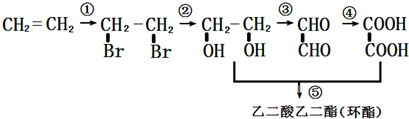
方程式①:CH2=CH2+Br2→CH2BrCH2Br;
方程式②:CH2BrCH2Br+2H2O$→_{△}^{氢氧化钠}$HOCH2CH2OH+2HBr;
方程式③:CH2OH-CH2OH+O2$\stackrel{一定条件}{→}$CHO-CHO+2H2O;
方程式④(写与银氨溶液反应的方程式):
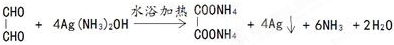 ;
;方程式⑤:HOOC-COOH+HOCH2CH2OH$→_{△}^{浓硫酸}$
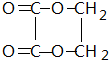 +H2O,;
+H2O,;乙烯和苯乙烯1:1的加聚反应方程式nCH2=CH2+nCH2=CH(C6H5)$\stackrel{引发剂}{→}$-CH2-CH2-CH2-CH(C6H5)-
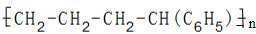 .
.
分析 ①乙烯与溴水发生加成反应生成1,2-二溴乙烷;
②1,2-二溴乙烷水解生成乙二醇;
③乙二醇催化氧化生成乙二醛;
④乙二醛与银氨溶液反应生成乙二酸铵、水、银和氨气;
⑤乙二酸与乙二醇发生酯化反应生成乙二酸乙二酯;
依据加聚反应原理书写方程式.
解答 解:①乙烯与溴水发生加成反应生成1,2-二溴乙烷,该反应为CH2=CH2+Br2→CH2BrCH2Br;
故答案为:CH2=CH2+Br2→CH2BrCH2Br;
②1,2-二溴乙烷水解生成乙二醇,方程式:CH2BrCH2Br+2H2O$→_{△}^{氢氧化钠}$HOCH2CH2OH+2HBr,
故答案为:CH2BrCH2Br+2H2O$→_{△}^{氢氧化钠}$HOCH2CH2OH+2HBr;
③乙二醇催化氧化生成乙二醛,方程式:CH2OH-CH2OH+O2$\stackrel{一定条件}{→}$CHO-CHO+2H2O;
故答案为:CH2OH-CH2OH+O2$\stackrel{一定条件}{→}$CHO-CHO+2H2O;
④乙二醛与银氨溶液反应生成乙二酸铵、水、银和氨气,方程式:: ;
;
故答案为: ;
;
⑤乙二酸与乙二醇发生酯化反应生成乙二酸乙二酯,方程式:HOOC-COOH+HOCH2CH2OH$→_{△}^{浓硫酸}$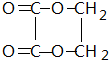 +H2O,
+H2O,
故答案为:HOOC-COOH+HOCH2CH2OH$→_{△}^{浓硫酸}$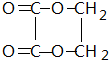 +H2O;
+H2O;
乙烯和苯乙烯1:1的加聚反应方程式:nCH2=CH2+nCH2=CH(C6H5)$\stackrel{引发剂}{→}$-CH2-CH2-CH2-CH(C6H5)-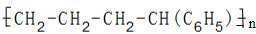 ;
;
故答案为:nCH2=CH2+nCH2=CH(C6H5)$\stackrel{引发剂}{→}$-CH2-CH2-CH2-CH(C6H5)-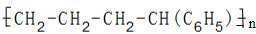 .
.
点评 本题考查有机方程式的书写,明确有机物的结构与性质是解题关键,注意甲醛与银氨溶液反应,1mol甲醛含有2mol-CHO,氧化生成碳酸铵,题目难度中等.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案| A. | 如果a1b1=a2b2,则混合溶液的pH>7 | |
| B. | 如果混合液的pH=7,则混合溶液中c(CH3COO-)=c(Na+) | |
| C. | 如果a1=a2,b1=b2,则混合液液中c(CH3COO-)=c(Na+) | |
| D. | 如果a1=a2,且混合溶液的pH<7,则b1>b2 |
 氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位.工业制硝酸的主要反应之一是
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位.工业制硝酸的主要反应之一是4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-akJ.mol-1(a>0)
(1)如果将4mol NH3和5molO2放入容器中,达到平衡
时放出热量0.8akJ,则平衡时NH3的转化率为80%.
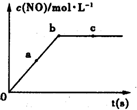
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO的浓
度与时间关系如图所示,则NO的a、b、c三点的反应速率
v(a正)、v(b逆)、v(c正)的大小关系是v(a正)<v(b逆)=v(c正).
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
| 浓度/mol.l-1 | C(NH3) | C(O2) | C(NO) | C(H2O) |
| 时间/min | ||||
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | 4.5 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 3.0 | 3.0 | 2.0 | 3.0 |
A.降低温度 B.增加了生成物 C.减小压强 D.使用了高效催化剂
B.在与第4min相同的温度下,若起始向容器中加入NH3、O2、NO和H2O(g)的浓度为2moI/L,则该反应正反应方向进行.(填“正反应方向进行”、“逆反应方向进行”、“不移动”).
(4)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2+2H2O(g)△H=-574KJ.mol-1
CH4+(g)4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160KJ.mol-1
则1mol甲烷直接将NO2还原为N2的焓变为-867kJ•mol-1.
(1)精炼铜时,阴极材料是纯铜,阴极的电极反应式是Cu2++2e-=Cu,
(2)氯碱工业电解饱和食盐水的总反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是Mn2++2H2O-2e-=MnO2+4H+
(4)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-离子.电池工作时正极反应式为O2+4e-=2O2-.
若以该电池为电源,用石墨做电极电解100mL含有如下离子的液.
| 离子 | Cu2+ | H+ | Cl- | SO$\stackrel{2-}{4}$ |
| c/(mol•L-1) | 1 | 4 | 4 | 1 |
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石,s)=C(石墨,s)△H=-1.90 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 氢气的燃烧热285.8kJ/mol,氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(l)△H=+285.8 kJ/mol | |
| D. | 氢氧化钡晶体与氯化铵晶体混合吸热,反应物的总键能之和高于生成物的总键能之和 |
| A. | 增大反应物浓度 | B. | 升高温度 | C. | 增大压强 | D. | 加入正催化剂 |
| A. | 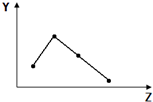 如图表示ⅥA族元素的氢化物的沸点 | |
| B. | 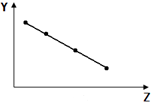 如图表示ⅦA族元素的熔点 | |
| C. | 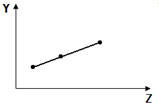 如图表示Na+、Mg2+、Al3+的半径 | |
| D. |  如图表示第三周期元素的单质的熔点 |