题目内容
【题目】为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如图所示:
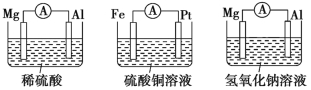
甲 乙 丙
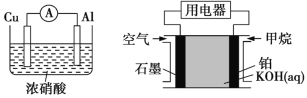
丁 戊
回答下列问题:
(1)根据原电池原理填写下表:
装置序号 | 正极 | 负极反应式 | 阳离子移动方向 |
甲 | |||
乙 | |||
丙 | |||
丁 | |||
戊 |
(2)电极类型除与电极材料的性质有关外,还与 有关。
(3)根据上述电池分析,负极材料是否一定参加电极反应? (填“是”、“否”或“不一定”),用上述电池说明: 。
(4)上述电池放电过程中,电解质溶液酸碱性的变化:甲 ,丙 ,戊 。(均填“酸性减弱”或“碱性减弱”)
【答案】(1)
装置序号 | 正极 | 负极反应式 | 阳离子 移动方向 |
甲 | Al | Mg2e | 移向铝极 |
乙 | Pt | Fe2e | 移向铂极 |
丙 | Mg | Al3e+4OH | 移向镁极 |
丁 | Al | Cu2e | 移向铝极 |
戊 | 石墨 | CH48e+10OH | 移向石墨 电极 |
(2)电解质溶液的性质
(3)不一定 在题述五个原电池中,戊装置的负极材料没有参与反应,其他电池的负极材料发生了氧化反应
(4)酸性减弱 碱性减弱 碱性减弱
【解析】(1)甲电池:在稀硫酸中,镁比铝活泼,镁为负极,发生氧化反应,铝为正极,H+在铝极上发生还原反应。乙电池:铁比铂活泼,铁为负极,发生氧化反应,铂为正极,Cu2+在铂极上被还原。丙电池:在氢氧化钠溶液中
(2)通过比较甲、丙电池可知,电极材料都是铝、镁,由于电解质溶液不同,故电极反应不同,即电极类型与电解质溶液也有关。
(3)大多数电池的负极材料发生氧化反应,但燃料电池的负极材料不参与反应,氢气、一氧化碳、甲烷、乙醇等可燃物在负极区发生氧化反应。
(4)根据电解质溶液中的反应情况判断溶液酸碱性的变化。
【备注】通常所说的活泼金属作负极,是依据金属活动顺序表的,即金属与酸反应的活泼性,但要注意铝和镁作原电池的电极,氢氧化钠溶液作电解质溶液时,铝作负极;还要注意常温下浓硝酸能使活泼的金属铝、铁钝化,使其不能参与原电池反应。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为2Cu + H2O |
方法d | 用肼(N2H4)还原新制Cu(OH)2 |
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-169kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-157kJ·mol-1
则方法a发生的热化学方程式是:________________________。
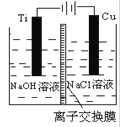
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:
该离子交换膜为______离子交换膜(填“阴”或“阳”),该电池的阳极反应式为:_____________ 钛极附近的pH值________ (增大、减小、不变)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为:____________。
(4)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O![]() 2H2+O2 ΔH>0
2H2+O2 ΔH>0
水蒸气的浓度随时间t变化如下表所示。
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.0500 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.1000 | 0.0940 | 0.0900 | 0.0900 | 0.0900 | 0.0900 |
①对比实验的温度T2_____ T1(填“>”“<”或“=”)。
②实验①前20 min的平均反应速率v(O2)=______。
③催化剂催化效率:实验①______实验② (填“>”、“<")。