题目内容
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为2Cu + H2O |
方法d | 用肼(N2H4)还原新制Cu(OH)2 |
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-169kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-157kJ·mol-1
则方法a发生的热化学方程式是:________________________。
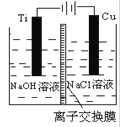
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:
该离子交换膜为______离子交换膜(填“阴”或“阳”),该电池的阳极反应式为:_____________ 钛极附近的pH值________ (增大、减小、不变)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为:____________。
(4)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O![]() 2H2+O2 ΔH>0
2H2+O2 ΔH>0
水蒸气的浓度随时间t变化如下表所示。
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.0500 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.1000 | 0.0940 | 0.0900 | 0.0900 | 0.0900 | 0.0900 |
①对比实验的温度T2_____ T1(填“>”“<”或“=”)。
②实验①前20 min的平均反应速率v(O2)=______。
③催化剂催化效率:实验①______实验② (填“>”、“<")。
【答案】 C(s)+2CuO(s)=Cu2O(s)+CO(g) ΔH=+ 34.5kJ/mol 阴 2Cu-2e-+2OH-=Cu2O+H2O 增大 4Cu(OH)2+ N2H4![]() 2Cu2O+N2↑+6H2O > 3.5×10-5mol/(L·min) <
2Cu2O+N2↑+6H2O > 3.5×10-5mol/(L·min) <
【解析】⑴.已知:① 2Cu(s)+1/2O2(g)=Cu2O(s)△H =-169kJ·mol-1
② C(s)+1/2O2(g)=CO(g)△H =-110.5kJ·mol-1
③ Cu(s)+1/2O2(g)=CuO(s)△H =-157kJ·mol-1
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为:C(s)+2CuO(s)=Cu2O(s)+CO(g)该反应可以是②-③×2-①÷2,反应的焓变是:-110.5kJmol-1-(-157kJmol-1×2)-(-169kJmol-1)÷2 = +34.5kJmol-1,
故答案为:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5kJmol-1;
⑵.方法c采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子浓度;在电解池中,当阳极是活泼电极时,该电极本身发生失电子的氧化反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O;钛极是阴极,发生氢离子得电子的还原反应,所以消耗氢离子,则PH值增大,故答案为:阴;2Cu-2e-+2OH-=Cu2O+H2O;增大;
⑶.根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,得出化学方程式为:4Cu(OH)2+N2H4![]() 2Cu2O+N2↑+6H2O,
2Cu2O+N2↑+6H2O,
故答案为:4Cu(OH)2+N2H4![]() 2Cu2O+N2↑+6H2O;
2Cu2O+N2↑+6H2O;
⑷.①. 该反应的正反应是吸热反应,升高温度平衡正向移动,水蒸气转化率增大,②和③相比,③转化率高,所以T2>T1,故答案为:>;
②前20min内用水蒸气表示的反应速率=(0.050-0.0486)mol/L÷20min =7×10-5mol/(Lmin),同一反应中同一段时间内各物质的反应速率之比等于其化学计量数之比,则用氧气表示的反应速率=3.5×10-5mol/(Lmin),故答案为:3.5×10-5mol/(Lmin);
③.实验①②对比,实验②到达平衡时间短,反应速率快,所以②中催化剂的催化效率高,故答案为:<。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案