��Ŀ����
����Ŀ����ɫ����N2O4��һ��ǿ��������Ϊ��Ҫ�Ļ���ƽ���֮һ��N2O4��NO2֮����ڷ�Ӧ:N2O4(g)![]() 2NO2 (g) ��H=+57.2 kJ/mol��
2NO2 (g) ��H=+57.2 kJ/mol��
(1)��һ����N2O4���뵽���º��ݵ��ܱ������С�
����˵���÷�Ӧ�ﵽƽ��״̬����____
a.v��(N2O4)=2v��(NO2)
b.������������¶Ȳ���
c.����������ƽ����Է�����������
d.��������ܶȲ���
�ڴﵽƽ��״̬����������������¶�,�ٴε���ƽ��״̬ʱ���������ɫ_______(����������dz�����䡱)�� �ж�����___________��
(2)��һ����N2O4���뵽���º�ѹ���ܱ�������(�¶�298K��ѹǿ100kPa)���÷�Ӧ�У�����Ӧ����v��=k����p(N2O4),�淴Ӧ����v��=k����p2(NO2),����k����k��Ϊ���ʳ���,pΪ��ѹ(��ѹ=��ѹ�����ʵ�������)����÷�Ӧ��ѹǿƽ�ⳣ��Kp=_____(��k����k����ʾ)������������k��=4.4��104s-1,��N2O4�ֽ�10%ʱ��v��=____kPa��s-1
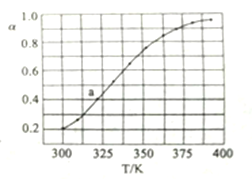
(3)��һ����N2O4���뵽�����ܱ������С���ò�ͬ�¶���,N2O4��ƽ��ת����a��ͼ��ʾ����֪N2O4����ʼѹǿp0Ϊ210kPa,����ͼ��a���Ӧ�¶��·�Ӧ��ѹǿƽ�ⳣ��Kp=______��
���𰸡� c ���� �÷�Ӧ����Ϊ���ȷ�Ӧ,����ʹƽ�������ƶ�,c(NO2)����������ɫ���� k��/k�� 3.6��106 224 kPa
����������1����a.v��(N2O4)=2v��(NO2)���������淴Ӧ������ȣ���Ӧû�дﵽƽ��״̬��a����b.�����Ǻ��º��ݣ�����������������¶Ȳ���������˵���÷�Ӧ�ﵽƽ��״̬��b������c.�������ƽ����Է��������ǻ�����������ͻ�������ܵ����ʵ����ı�ֵ���������䣬�����ʵ����DZ仯�ģ���������������ƽ����Է�����������˵���÷�Ӧ�ﵽƽ��״̬��c��ȷ��d.�ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ�������������ݻ�ʼ���Dz���ģ����Ի�������ܶȲ���������˵���÷�Ӧ�ﵽƽ��״̬��d����ѡc���ڴﵽƽ��״̬����������������¶ȣ�����Ӧ���ȣ�ƽ��������Ӧ������У�NO2Ũ�������ٴε���ƽ��״̬ʱ���������ɫ�����2��ƽ��ʱ����������ȣ�����v��=k����p(N2O4)��v��=k����p2(NO2)�������ɵ�Kp=K��/K������N2O4�ֽ�10%ʱ����Ͷ���N2O4Ϊ1mol��ת����N2O4Ϊ0.1mol������ݷ���ʽ��֪
N2O4��g��![]() 2NO2��g�� ���ʵ��������n
2NO2��g�� ���ʵ��������n
1mol 2mol��1mol=1mol
0.1mol 0.1mol
�ʴ�ʱp��N2O4��=![]() ����v��=4.4��l04s-1��
����v��=4.4��l04s-1��![]() =3.6��106 kPas-1����3����N2O4����ʼ����1mol��a��ת������0.4������ݷ���ʽ��֪
=3.6��106 kPas-1����3����N2O4����ʼ����1mol��a��ת������0.4������ݷ���ʽ��֪
N2O4��g��![]() 2NO2��g��
2NO2��g��
��ʼ����mol�� 1 0
ת������mol�� 0.4 0.8
ƽ������mol�� 0.6 0.8
����ƽ����ѹǿ��1.4��210kPa��294 kPa������a���Ӧ�¶��·�Ӧ��ѹǿƽ�ⳣ��Kp= ��
��