题目内容
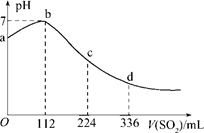
锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体33.6L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+)="0.1" mol/L,下列叙述正确的是( )
| A.反应中共消耗1.85 mol H2SO4 | B.反应中共消耗97.5 g Zn |
| C.反应中共转移6 mol电子 | D.气体中SO2与H2的体积比为4:1 |
B
由于浓硫酸在反应中会逐渐变稀,所以反应中会产生氢气,即33.6L气体是SO2和氢气的混合气,物质的量是33.6L÷22.4L/mol=1.5mol,转移电子是3.0mol,所以根据电子得失守恒可知,消耗锌是1.5mol,质量是1.5mol×65g/mol=97.5g,B正确,C不正确。剩余硫酸是0.05mol,所以消耗硫酸是1.80mol,A不正确。生成硫酸锌是1.5mol,所以被还原的硫酸是1.80mol-1.50mol=0.30mol,则生成SO2是0.3mol,因此氢气是1.2mol,即气体中SO2与H2的体积比为1:4,D不正确。答案选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目