题目内容
将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s)+H2O(g) CO(g)+H2(g)。
CO(g)+H2(g)。
而C(g)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
②H2(g)+ O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
③CO(g)+ O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
请你根据上述信息回答下列问题:
(1)煤是一种成分复杂的混合物,其中除含碳、氢元素外,还含有氧、硫、氮、砷、硒等元素。所以固体煤燃烧会导致大气污染,写出煤燃烧产生的两种污染: ,将石灰石粉与煤粉混合,可以有效地减少煤燃烧过程中的二氧化硫污染,写出该反应的化学方程式:____________________
(2)根据已知热化学方程式写出由煤制备水煤气的热化学方程式:____________________________。
(3)下面是甲、乙两位同学对上述热化学方程式及煤燃烧的理解。
甲同学:1 mol CO与1 mol H2燃烧放出的热量之和大于1 mol固体炭燃烧放出的热量,所以煤燃烧时加入少量水,可以使煤燃烧放出更多的热量。
乙同学:根据下面的物质与能量循环,将煤炭转化为水煤气,再燃烧放出的热量与直接燃烧煤炭放出的热量相同,而将煤炭转化为水煤气将会增加消耗,故煤炭转化为水煤气得不偿失。
C(s)+H2O(g)+O2(g) CO2(g)+H2O(g)
CO2(g)+H2O(g)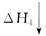

CO(g)+O2(g)+H2(g)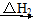 CO(g)+H2O(g)+
CO(g)+H2O(g)+ O2(g)
O2(g)
请你评价两位同学的理解:
①甲同学的说法 (答“正确”或“不正确”),原因是______________________________________。
②乙同学的说法 (答“正确”或“不正确”),原因是_____________________________________。
(1)酸雨(或答“二氧化硫污染大气”)、含砷粉尘污染、氮氧化物污染(答出两种即可)
2SO2+2CaCO3+O2=2CaSO4+2CO2
(2)C(s)+H2O(g)=CO(g)+H2(g)ΔH=+131.5 kJ·mol-1
(3)①不正确 加入水,水汽化需要吸收能量
②不正确 尽管将煤炭转化为水煤气再燃烧放出的热量与直接燃烧煤炭放出的热量相同,但水煤气与氧气接触面积大,反应速率快,燃烧充分,能量利用率高,污染小
解析

根据下列条件计算有关反应的焓变:
(1)已知:
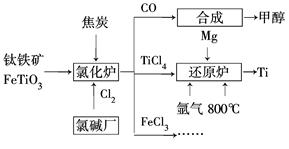
Ti(s)+2Cl2(g)===TiCl4(l) ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)==="2NaCl(s)" ΔH=-882.0 kJ·mol-1
Na(s)===Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)===Ti(s)+4NaCl(s)的ΔH= kJ·mol-1。
(2)已知下列反应数值:
| 序号 | 化学反应 | 反应热 |
| ① | Fe2O3(s)+3CO(g)=== 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
| ② | 3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol-1 |
| ③ | Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
| ④ | FeO(s)+CO(g)===Fe(s)+CO2(g) | ΔH4 |
则反应④的ΔH4= kJ·mol-1。
2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒。
汽车尾气净化的主要原理为:2NO(g)+2CO(g)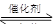 2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:
2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断: 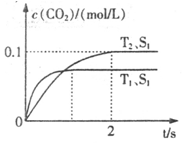
(1)该反应为 反应(填“放热”或“吸热”):在T2温度下,0~2s内的平均反应速率:v(N2)= ;(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在答题卡上画出 c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(3)某科研机构,在t1℃下,体积恒定的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度(具体数据见下表,CO2和N2的起始浓度为0)。
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/xl0-4mol L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/xl0-3mol L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃时该反应的平衡常数K= ,平衡时NO的体积分数为 。
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
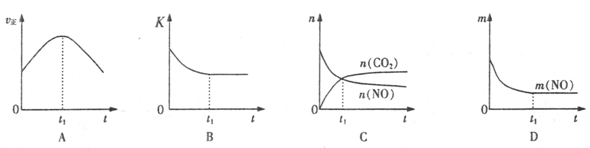
(5)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) = N2 (g)+CO2 (g)+2H2O(g) △H=-867.0kJ ? mol-1
2NO2 (g)
 N2O4 (g) △H=-56.9kJ ? mol-1
N2O4 (g) △H=-56.9kJ ? mol-1H2O(g) = H2O(l) △H=-44.0kJ ? mol-1
写出CH4催化还原N2O4 (g)生成N2 (g)、CO2 (g)和H2O(l)的热化学方程式 。
磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物有着广泛的应用。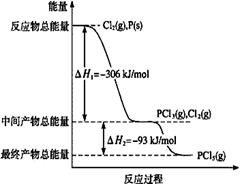
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
请回答问题:
①PCl5分解成PCl3和Cl2的热化学方程式是 。
②P和Cl2分两步反应生成1 mol PCl5的△H3= 。
(2)PCl5分解成PCl3和Cl2的反应是可逆反应。T℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过250 s达到平衡。反应过程中测定的部分数据见下表:
| t / s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3) / mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
①反应在50~150s 内的平均速率v(PCl3)= 。
②试计算该温度下反应的平衡常数(写出计算过程,保留2位有效数字)
(3)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示。
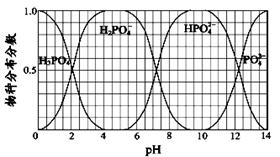
①为获得较纯的Na2HPO4,pH应控制在 ;pH=6时,溶液中主要含磷物种浓度大小关系为: 。
②Na2HPO4溶液呈碱性,加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从离子平衡角度分析) 。
(1)①根据下列图示,写出反应的热化学方程式____________________________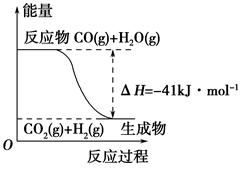
②根据如图所示情况,判断下列说法中正确的是______________。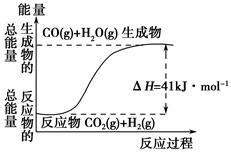
| A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol-1 |
| B.该反应为吸热反应 |
| C.该反应为放热反应 |
| D.当H2O为液态时,其反应热值小于41 kJ·mol-1 |
(3)如图是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为___________________________
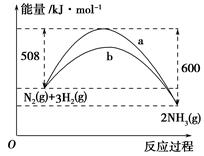
a、b两条曲线产生区别的原因很可能是
_________________________________________________________________。
 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为: O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1