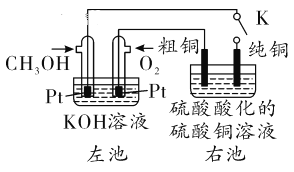
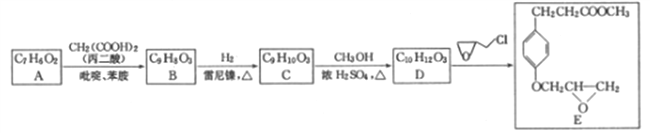
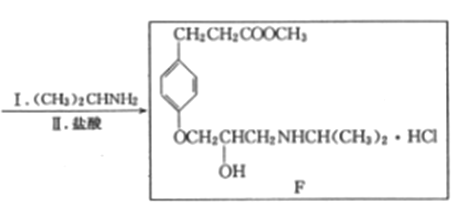
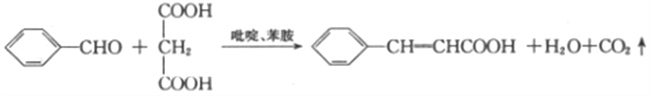
��Ŀ����
����Ŀ��NaCN(�軯��)��һ����Ҫ�Ļ�������ԭ��,�����ڵ�ơ�ұ����л��ϳɵȡ��ش��������⡣
��1��NaCN��Һ�з���ˮ�ⷴӦ�����ӷ���ʽΪ_______________________________,ʵ��������NaCN��Һ�ķ�����______________________________��
��2��NaCN��Cl2��Ӧ���Ʊ�ClCN(����)������ĵ���ʽΪ_________��
��3���Ʊ�NaCN�ķ����ܶ��֡�
�ٰ��Ʒ�����Ӧԭ��Ϊ2Na+2C+2NH3![]() 2NaCN+3H2���÷�Ӧ��,ÿ����1molNaCN,ת�Ƶ��ӵ����ʵ���Ϊ_________��
2NaCN+3H2���÷�Ӧ��,ÿ����1molNaCN,ת�Ƶ��ӵ����ʵ���Ϊ_________��
��NaCNҲ����HCN ��NaOH��Ӧ�Ƶá�
��֪��CH4(g)=C(s)+2H2(g) ��H1��
2HCN(g)=2C(s)+H2(g)+N2(g) ��H2;
N2(g)+3H2(g)![]() 2NH3(g) ��H3��
2NH3(g) ��H3��
��Ӧ��CH4(g)+NH3(g)![]() HCN(g)+3H2(g)�ġ�H=____________(�ú���H1����H2����H3�Ĵ���ʽ��ʾ)��
HCN(g)+3H2(g)�ġ�H=____________(�ú���H1����H2����H3�Ĵ���ʽ��ʾ)��
���𰸡� CN-+H2O![]() HCN+OH- ��NaCN�ܽ��ڽ�Ũ��NaOH��Һ��,Ȼ���ټ�ˮϡ��
HCN+OH- ��NaCN�ܽ��ڽ�Ũ��NaOH��Һ��,Ȼ���ټ�ˮϡ�� ![]() 3mol
3mol ![]()
����������1�����⿼������ˮ�ⷽ��ʽ����д����ˮ�����ʵ����ƣ�NaCN����ǿ�������Σ�CN������ˮ�⣬��ˮ������ӷ���ʽΪCN����H2O![]() HCN��OH��������NaCN��Һʱ��Ϊ����CN��ˮ�⣬��Ҫ��NaCN�ܽ��ڽ�Ũ��NaOH��Һ�У�Ȼ���ˮϡ�ͣ���2�����⿼�����ʽ����д��ClCN�ĵ���ʽ������HCN��HCN�ĵ���ʽΪH��CN����ClCN�ĵ���ʽΪ
HCN��OH��������NaCN��Һʱ��Ϊ����CN��ˮ�⣬��Ҫ��NaCN�ܽ��ڽ�Ũ��NaOH��Һ�У�Ȼ���ˮϡ�ͣ���2�����⿼�����ʽ����д��ClCN�ĵ���ʽ������HCN��HCN�ĵ���ʽΪH��CN����ClCN�ĵ���ʽΪ![]() ����3���ٱ��⿼��������ԭ��Ӧ�е���ת�ƣ����ݻ�ѧ��Ӧ����ʽ��Na�Ļ��ϼ���0�ۡ���1�ۣ����ϼ����ߣ�C��0�ۡ���2�ۣ�NH3��H�ɣ�1�ۡ�0�ۣ�����1molNaCN������1molNH3����ת�Ƶ������ʵ���1��3mol=3mol���ڱ��⿼���Ȼ�ѧ��Ӧ����ʽ���㣬CH4(g)=C(s)+2H2(g) �٣�2HCN(g)=2C(s)+H2(g)+N2(g) �ڣ�N2(g)+3H2(g) 2NH3(g) �ۣ�����Ŀ�귴Ӧ���̷�ʽ����ˢ٣���/2����/2�ó���H=��H1����H2/2����H3/2��
����3���ٱ��⿼��������ԭ��Ӧ�е���ת�ƣ����ݻ�ѧ��Ӧ����ʽ��Na�Ļ��ϼ���0�ۡ���1�ۣ����ϼ����ߣ�C��0�ۡ���2�ۣ�NH3��H�ɣ�1�ۡ�0�ۣ�����1molNaCN������1molNH3����ת�Ƶ������ʵ���1��3mol=3mol���ڱ��⿼���Ȼ�ѧ��Ӧ����ʽ���㣬CH4(g)=C(s)+2H2(g) �٣�2HCN(g)=2C(s)+H2(g)+N2(g) �ڣ�N2(g)+3H2(g) 2NH3(g) �ۣ�����Ŀ�귴Ӧ���̷�ʽ����ˢ٣���/2����/2�ó���H=��H1����H2/2����H3/2��

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�