题目内容
8.下列无色溶液中,离子能大量共存的是( )| A. | Na+、H+、AlO2-、C1- | B. | ClO-、K+、OH一、HSO3- | ||
| C. | K+、Na+、SiO32-、SO42一 | D. | K+、A13+、Cl-、HCO3- |
分析 无色溶液可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.氢离子与偏铝酸根离子反应;
B.次氯酸根离子能够氧化亚硫酸氢根离子,氢氧根离子能够与亚硫酸氢根离子反应;
C.四种离子之间不反应,都是无色离子,能够共存;
D.碳酸氢根离子与铝离子发生双水解反应.
解答 解:溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.H+、AlO2-之间发生反应,在溶液中不能大量共存,故A错误;
B.OH-与HSO3-反应,ClO-与HSO3-之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.K+、Na+、SiO32-、SO42-之间不反应,都是无色离子,在溶液中能够大量共存,故C正确;
D.A13+、HCO3-之间发生双水解反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;还应该注意题目所隐含的条件,如:溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
18.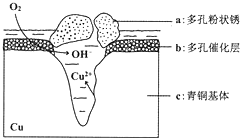 如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )
如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )
 如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )
如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )| A. | 腐蚀过程中,铜被氧化 | |
| B. | 已知环境中的 Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,则其离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| C. | 若生成 4.29 g Cu2(OH)3Cl,则理论上耗氧体积定为 0.448 L | |
| D. | 正极的电极反应式为:O2+4e-+2H2O=4OH- |
19.除去表中物质中含有杂质,所选试剂错误的是( )
| 选项 | 物质 | 杂质 | 试剂及操作 |
| A | 氢氧化钠 | 硫酸钠 | 加入适量氢氧化钙,过滤 |
| B | 生石灰 | 碳酸钙 | 高温锻烧 |
| C | 二氧化碳 | 一氧化碳 | 通过有足量灼烧氧化铁的玻璃管 |
| D | 氧化铜粉末 | 木炭粉 | 隔绝空气加强热 |
| A. | A | B. | B | C. | C | D. | D |
3.化学与生活密切相关,下列有关说法正确的是( )
| A. | 油脂、乙酸乙酯都属于酯类,水解后都会生成乙醇 | |
| B. | 人的皮肤在强紫外线的照射下将会失去生理活性 | |
| C. | 棉花和蚕丝的主要成分都是纤维素 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
13.已知可逆反应:2N2H4(g)+2NO2(g)?3N2(g)+4H2O(g)△H>0.下列有关说法正确的是( )
| A. | 加压有利于化学平衡向正反应方向移动 | |
| B. | 该反应的化学平衡常数表达式为:K=$\frac{{c}^{2}{N}_{2}{H}_{4}×{c}^{2}N{O}_{2}}{{c}^{3}{N}_{2}×{c}^{4}{H}_{2}O}$ | |
| C. | 升高温度可缩短反应达平衡的时间但不能提高平衡转化率 | |
| D. | 使用催化剂可缩短反应达平衡的时间但不能提高平衡转化率 |
17. Ⅰ已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如表:
Ⅰ已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如表:
(1)通过表格中的数值可以推断:反应①是吸热(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)?CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学
表达式:K3=$\frac{[CO]•[{H}_{2}O]}{[{H}_{2}]•[C{O}_{2}]}$.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式K3=$\frac{{K}_{1}}{{K}_{2}}$.根据此关系式及表格数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应.
Ⅱ在一密闭容器中发生反应N2+3H2?2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
(1)处于平衡状态的时间段是ACDF(填选项字母).
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项).
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氮气
t1时刻C;t4时刻B.
(3)依据(2)中的结论,下列时间段中,氨的百分含量最低的是D(填选项字母).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6.
 Ⅰ已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如表:
Ⅰ已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如表:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.33 |
| 1173K | 2.15 | 1.67 |
(2)现有反应③:CO2(g)+H2(g)?CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学
表达式:K3=$\frac{[CO]•[{H}_{2}O]}{[{H}_{2}]•[C{O}_{2}]}$.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式K3=$\frac{{K}_{1}}{{K}_{2}}$.根据此关系式及表格数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应.
Ⅱ在一密闭容器中发生反应N2+3H2?2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
(1)处于平衡状态的时间段是ACDF(填选项字母).
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项).
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氮气
t1时刻C;t4时刻B.
(3)依据(2)中的结论,下列时间段中,氨的百分含量最低的是D(填选项字母).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6.
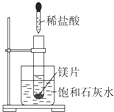 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入一小块镁片,再用滴管滴入10mL 0.2mol/L的稀盐酸于试管中,测得生成氢气在标况的体积为11.2mL后反应停止,同时观察到盛饱和石灰水的烧杯中出现浑浊的现象.请回答下列问题:
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入一小块镁片,再用滴管滴入10mL 0.2mol/L的稀盐酸于试管中,测得生成氢气在标况的体积为11.2mL后反应停止,同时观察到盛饱和石灰水的烧杯中出现浑浊的现象.请回答下列问题: