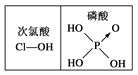
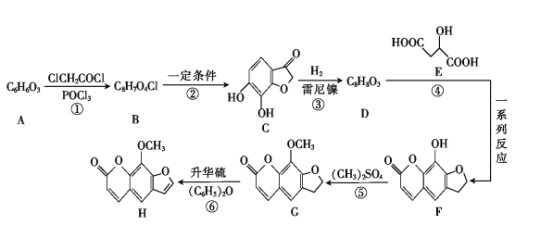
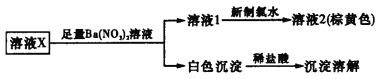
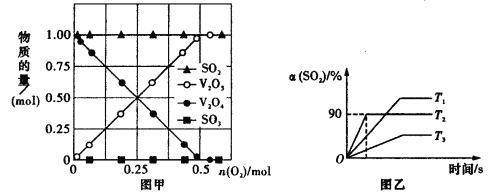
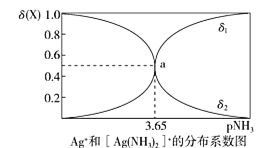
题目内容
【题目】已知反应H2(g)+Br2(g)![]() 2HBr(g)分下列三步进行,有关键能如下表所示:
2HBr(g)分下列三步进行,有关键能如下表所示:

①Br2![]() 2Br(快反应) △H1,K1
2Br(快反应) △H1,K1
②Br+H2![]() HBr+H(慢反应) △H2,K2
HBr+H(慢反应) △H2,K2
③H+Br![]() HBr(快反应) △H3,K3
HBr(快反应) △H3,K3
则下列说法错误的是
A.△H1>△H2>△H3
B.25℃时:K1>K3
C.H2(g)+Br2(g)![]() 2HBr(g)的速率由反应②的速率决定
2HBr(g)的速率由反应②的速率决定
D.H2(g)+Br2(g)![]() 2HBr(g) △H<0
2HBr(g) △H<0
【答案】B
【解析】
A.根据所给键能计算,△H1=200kJ/mol;△H2=436-369=67 kJ/mol;△H3=-369 kJ/mol;所以△H1>△H2>△H3,故A项正确;
B.25C时,①Br2![]() 2Br是吸热反应,断键不自发进行,反应物多,③H+Br
2Br是吸热反应,断键不自发进行,反应物多,③H+Br![]() HBr是放热反应,成键能自发进行,生成物多。根据平衡常数的表达式可知K1<K2,故B项错误;
HBr是放热反应,成键能自发进行,生成物多。根据平衡常数的表达式可知K1<K2,故B项错误;
C.由①Br2![]() 2Br(快反应)△H1,K1、②Br+H2
2Br(快反应)△H1,K1、②Br+H2![]() HBr+H(慢反应)△H2,K2、③H+Br
HBr+H(慢反应)△H2,K2、③H+Br![]() HBr(快反应)△H3,K3三个反应可知,反应②最慢,是决定速率大小的反应,故C正确;
HBr(快反应)△H3,K3三个反应可知,反应②最慢,是决定速率大小的反应,故C正确;
D. H2(g)+Br2(g)![]() 2HBr(g) △H=436+200-369
2HBr(g) △H=436+200-369![]() =-102 kJ/mol<0,故D正确;
=-102 kJ/mol<0,故D正确;
故选B。

【题目】研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
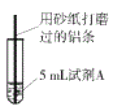
实验序号 | 试剂A | 实验现象 |
1 | 0.2mol/LCuCl2溶液 | 铝条表面有气泡产生,并有红色固体析出 |
2 | 0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体 | 开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出 |
3 | 2mol/LCuSO4溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
4 | 2mol/LCuCl2溶液 | 反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成 |
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为______g。
(3)实验3的目的是_________ 。
(4)经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。
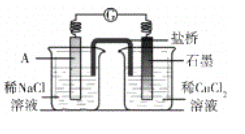
①A极的电极材料是_________。
②能证明该反应发生的实验现象是_________ 。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
实验序号 | 实验操作 | 实验现象 |
i | 加入浓NaCl溶液 | 沉淀溶解,形成无色溶液 |
ii | 加入饱和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
iii | 向i所得溶液中加入2mol/LCuCl2溶液 | 溶液由无色变为褐色 |
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]
①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与_____作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是_______。
(6)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______有关。