题目内容
(6分)下图为氢氧燃料电池的示意图:

⑴若以稀硫酸为电解液,则a极为___ _极。
⑵若以KOH溶液作电解液,则b极上的电极反应式为_______________________,放电一段时间后电解液的pH将________(填“变大”、“变小”或“不变”)。

⑴若以稀硫酸为电解液,则a极为___ _极。
⑵若以KOH溶液作电解液,则b极上的电极反应式为_______________________,放电一段时间后电解液的pH将________(填“变大”、“变小”或“不变”)。
(每空2分,共6分) (1)负,(2)O2+2H2O+4e-=4OH-,变小
(1)氢气在反应中失去电子,所以在负极通入,即a是负极。
(2)氧气得到电子,在正极通入,电极反应式为O2+2H2O+4e-=4OH-。由于在反应中产生水,所以氢氧化钾溶液的浓度降低,pH变小。
(2)氧气得到电子,在正极通入,电极反应式为O2+2H2O+4e-=4OH-。由于在反应中产生水,所以氢氧化钾溶液的浓度降低,pH变小。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 )是重要的能源物质,研究甲醇具有重要意义。
)是重要的能源物质,研究甲醇具有重要意义。 可制取甲醇,其反应为:
可制取甲醇,其反应为:

 的
的  晶体,在高温下它能传导
晶体,在高温下它能传导 离子。电池工作时正极反应为 。
离子。电池工作时正极反应为 。
 氧化成
氧化成 ,然后以
,然后以
 ,该过程中被氧化的元素是 ,当产生标准状况下2.24L
,该过程中被氧化的元素是 ,当产生标准状况下2.24L M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。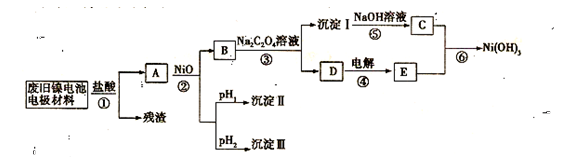

 Pb+PbO2+2H2SO4,下列判断不正确的是( )
Pb+PbO2+2H2SO4,下列判断不正确的是( )
 ,
,

 ,则氢气的燃烧热
,则氢气的燃烧热
