题目内容
【题目】Ⅰ甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使甲醚在制药、燃料、农药等化学工业中有许多独特的用途。
(1)已知:2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
![]()
①平衡时,c(CH3OCH3)等于________ mol·L-1,反应混合物的总能量减少________ kJ。
②若在平衡后的容器中再加入与起始时等量的CH3OH,请在下图中画出CH3OH的浓度的曲线示意图。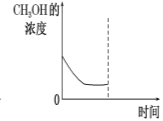
Ⅱ甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+ CO(g)![]() CH3OH(g)
CH3OH(g)
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
![]()
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”).
②按下列物质的量发生反应,CO的转化率由大到小的顺序是 (填甲乙丙).

(3)已知在常温常压下:化学反应①②③④的平衡常数分别为K1,K2,K3,K4
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) K1
②2CO(g)+O2(g)=2CO2(g)K2
③H2O(g)=H2O(l)K3
④CH3OH(l)+O2(g)=CO(g)+2H2O(l)K4
则K4= (用含有K1,K2,K3的代数式表达)
【答案】
Ⅰ(1)①1.6 , 40 , ②如图所示
Ⅱ(2)①K= ![]() ②< ③甲>丙>乙 (3)
②< ③甲>丙>乙 (3)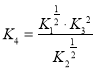
【解析】
试题分析:(1)①根据表中数据以及反应的化学方程式可知甲醇的起始浓度是0.8mol/L+1.24mol/L×2=3.28mol/L
2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
起始浓度(mol/L) 3.28 0 0
转化浓度(mol/L) 2x x x
平衡浓度(mol/L)3.28-2x x x
则![]()
解得x=1.6
所以平衡时,c(CH3OCH3)等于1.6mol·L-1。消耗甲醇是3.2mol,所以反应混合物的总能量减少![]() 。
。
②若在平衡后的容器中再加入与起始时等量的CH3OH,则相当于是增大压强,反应前后体积不变,则平衡
(2)①在一定温度下,一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数比值,根据方程式可知该反应的平衡常数表达式K=![]() 。根据表中数据可知升高温度平衡常数减小,这说明升高温度平衡向逆反应方向进行,因此上述反应的正反应是放热反应,则△H<0。
。根据表中数据可知升高温度平衡常数减小,这说明升高温度平衡向逆反应方向进行,因此上述反应的正反应是放热反应,则△H<0。
②甲相当于在丙的基础上增大氢气浓度,提高CO的转化率。乙相当于在丙的基础上增大CO浓度,提高氢气的转化率,但降低CO的转化率,则CO的转化率由大到小的顺序是甲>丙>乙。
(3)已知①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) K1
②2CO(g)+O2(g)=2CO2(g)K2
③H2O(g)=H2O(l)K3
④CH3OH(l)+O2(g)=CO(g)+2H2O(l)K4
则根据盖斯定律可知①÷2+③×2-②÷2即得到反应④,所以反应④的平衡常数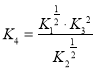 。
。