题目内容
【题目】已知1-丁醇的沸点为117.7℃,乙酸的沸点为118℃。甲同学拟在浓硫酸作用下,使1-丁醇和乙酸进行酯化反应制乙酸丁酯(反应温度115~125℃)。
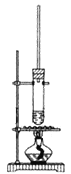
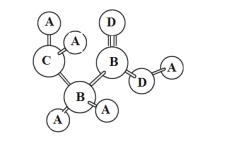
(1)反应装置不使用水浴加热或直接加热,而采取如图加热操作方式,其原因是____________________________。
(2)操作中使用相对较多乙酸的理由是______________________________。
(3)洗涤粗产物:将粗产物移至分液漏斗中,先用水洗涤,然后用10%Na2CO3溶液洗涤至中性,再用水洗涤,分液得有机层。如果不能判断哪层是有机层,可以用__________方法来判断。对有机层,进行洗涤除杂、除水后可得到粗产品。
(4)收集产物:将干燥好的产物移至蒸馏烧瓶中,加热蒸馏,收集125~127℃的馏分。要证明最终产物是纯净的乙酸丁酯,其方法是__________________________________。乙同学拟通过蒸馏的方法将1-丁醇和乙酸的无水混合物分离开。
实验步骤:①连接好装置,检查装置的气密性。②将混合物加入到蒸馏烧瓶中,并加入适量的试剂a。③加热到118℃,并收集馏分。④冷却后,再向烧瓶中加入试剂b。⑤加热到118℃,并收集馏分。
(5)试剂a 是___________,其作用是_________________________________。
(6)下列实验也需要用到温度计的是 ____________。
a.实验室制备硝基苯 b.实验室制备溴苯 c.实验室制备乙烯 d.银镜反应
【答案】反应温度为115~125℃不能水浴,直接加热容易炭化 乙酸相对廉价,提高1-丁醇的转化率 从任意一层取少量液体加水,如混溶则该层为水层;不混溶则为有机层 测定产品的沸点 生石灰 让乙酸反应后生成高沸点的离子化合物,以提高1-丁醇的纯度 a、c
【解析】
(1)1-丁醇的沸点为117.7℃,乙酸的沸点为118℃,都比水的沸点高,则不能用水浴的方法加热,否则达不到反应温度,火焰不与试管接触,可防止直接加热到导致碳化;
(2)加入乙酸平衡右移,可提高1-丁醇的转化率,且乙酸相对价格较为便宜;
(3)乙酸丁酯与水互不相溶,可从任意一层取少量液体加水,如混溶则该层为水层,不混溶则为有机层;
(4)混合物没有固定的熔沸点,可通过测定产品的沸点判断,如有固定的沸点,则为纯净物,否则不是;
(5)乙酸具有酸性,可与CaO等碱性物质反应,让乙酸反应后生成高沸点的离子化合物,利于分馏分离;
(6)实验室制备硝基苯需要加热到50~60℃;制备乙烯需要加热到170℃,而制备溴苯无需加热,而银镜反应可用沸水浴,无需加热,所以选a、c。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案