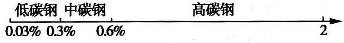题目内容
分别用一种试剂鉴别下列物质:
(1)(NH4)2SO4、NaCl与CH3COONa的溶液;
(2)Al2(SO4)3、MgSO4、FeSO4、Fe2(SO4)3、CuSO4与Na2SO4的溶液;
(3)Na2SiO3、Na2S、Na2CO3、Na2S2O3、NaCl的溶液;
(4)Na2SO4、NH4Cl、NaCl、(NH4)2SO4的溶液;
(5)Al2(SO4)3、H2SO4、Ba(OH)2、CaCl2的溶液;
(6)HCOOH、CH3COOH、C2H5OH、葡萄糖的溶液。
解析:
解题思路:只允许用一种试剂鉴别的题目,由于限制了试剂的种类,因而也就增加了题目的难度。要熟练解答这类习题,不但要熟练地掌握各类物质的性质和它们与某物质相互反应的规律及实验现象,而且还必须有科学的解题思路。 常见的解题思路有以下几种: ①若几种溶液的酸碱性不同时,可选适当的指示剂或pH试纸鉴别。如(1)题因NaCl不水解,溶液呈中性;而(NH4)2SO4和CH3COONa都能水解分别使溶液呈酸性和碱性。所以用石蕊试液或pH试纸就可鉴别开来。 ②若几种溶液含有不同的阳离子,可考虑用强碱溶液与它们分别反应,根据生成物的颜色、稳定性,及在过量碱液中的溶解情况而加以鉴别。如(2)题可用NaOH溶液鉴别。根据生成蓝色沉淀鉴出 CuSO4;红褐色沉淀鉴出Fe2(SO4)3;白色沉淀且立即变灰绿色,最终变红褐色鉴出FeSO4;有白色沉淀且沉淀能溶于NaOH溶液鉴出Al2(SO4)3;白色沉淀不溶于NaOH溶液鉴出MgCl2;无现象的为Na2SO4。 ③若几种溶液中含有不同的阴离子,可考虑使用强酸,根据生成物的状态、颜色、气味等差别加以鉴别。如(3)题可用稀硫酸或稀盐酸鉴别。6种溶液分别与稀盐酸反应,产生白色沉淀的为Na2SiO3;有臭鸡蛋气味的为Na2S;有无色无味气体产生的为Na2CO3;有无色刺激性气味气体产生的为Na2SO3;使溶液变浑浊且产生无色刺激性气味气体的为 Na2S2O3;无现象的为NaCl。 ④若几种物质间有的含有相同的阳离子,有的含有相同的阴离子,可考虑用既与相同的阳离子反应,又与相同的阴离子反应的试剂来鉴别。如(4)题可用Ba(OH)2溶液鉴别,实验在加热的情况下进行,只有白色沉淀产生的为Na2SO4;只有气体产生的为 NH4Cl;既有白色沉淀又有气体产生的为(NH4)2SO4;无现象的为NaCl。 ⑤若被鉴别物质中有能强烈水解的盐,可考虑用与之能发生双水解反应且与该组中其他物质发生不同反应的盐溶液鉴别。如(5)题可用(NH4)2CO3溶液鉴别。分别反应时,若既有白色沉淀,又有无色无味气体产生的是Al2(SO4)3;只有无色无味气体产生的是H2SO4;既有白色沉淀,又有刺激性气味气体生成的是Ba(OH)2;只有白色沉淀的是CaCl2。此外,也可选用NaHCO3溶液鉴别。 ⑥鉴别有机物时,若被鉴别物质中含有醛基、羧基,应先考虑用新制得的Cu(OH)2悬浊液鉴别。被鉴别物质中含有酚的,可考虑用Fe3+利用显色反应鉴别。如(6)中可用新制得的Cu(OH)2悬浊液鉴别。分别反应时悬浊液变为蓝色溶液的是甲酸和乙酸;变为深蓝色溶液,加热煮沸时又产生红色沉淀的是葡萄糖;无此现象的是乙醇。 参考答案:(1)石蕊试液等 (2)NaOH溶液 (3)稀盐酸等 (4)Ba(OH)2溶液 (5)(NH4)2CO3溶液 (6)新制碱性Cu(OH)2悬浊液
|

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案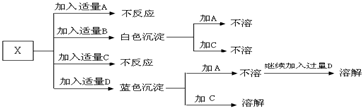 A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种.现利用另一种常见溶液X,用下图所示的方法,可将它们一一确定.请回答以下问题:
A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种.现利用另一种常见溶液X,用下图所示的方法,可将它们一一确定.请回答以下问题:
(1)B的化学式是______A的电子式为______
(2)写出在X溶液中加入过量NH3?H2O的离子反应方程式______.
(3)有学生分别用其他试剂来鉴别上述四种溶液:
①用物质Y一次性鉴别上述四种物质,结果发现第一种溶液中反应后溶液呈黄色,第二种溶液中有白色沉淀产生,第三种溶液中有能使湿润的红色石蕊试纸变蓝的气体产生,则Y是______(用化学式表示).Y溶液与稀硝酸反应的离子方程式为______.
②若用明矾鉴别上述四种物质,写出能检验出NH4Cl溶液所涉及的所有离子反应方程式:Ba2++SO42-=BaSO4↓、______.
③有学生用MgSO4来鉴别上述四种溶液,在生成的白色沉淀Mg(OH)2中分别加入HNO3和NH4Cl溶液,发现沉淀均溶解.有以下两种解释,同时提供下表数据:
A.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+水解产生H+的缘故.
B.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+结合OH-的缘故.
| 电解质 | HF | HCOOH | CH3COOH | HCN | NH3?H2O |
| 电离度 | 8.00% | 7.16% | 1.32% | 0.01% | 1.33% |
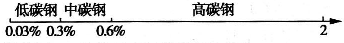
 A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种.现利用另一种常见溶液X,用下图所示的方法,可将它们一一确定.请回答以下问题:
A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种.现利用另一种常见溶液X,用下图所示的方法,可将它们一一确定.请回答以下问题: