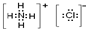题目内容
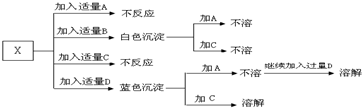 A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种.现利用另一种常见溶液X,用下图所示的方法,可将它们一一确定.请回答以下问题:
A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种.现利用另一种常见溶液X,用下图所示的方法,可将它们一一确定.请回答以下问题:
(1)B的化学式是______A的电子式为______
(2)写出在X溶液中加入过量NH3?H2O的离子反应方程式______.
(3)有学生分别用其他试剂来鉴别上述四种溶液:
①用物质Y一次性鉴别上述四种物质,结果发现第一种溶液中反应后溶液呈黄色,第二种溶液中有白色沉淀产生,第三种溶液中有能使湿润的红色石蕊试纸变蓝的气体产生,则Y是______(用化学式表示).Y溶液与稀硝酸反应的离子方程式为______.
②若用明矾鉴别上述四种物质,写出能检验出NH4Cl溶液所涉及的所有离子反应方程式:Ba2++SO42-=BaSO4↓、______.
③有学生用MgSO4来鉴别上述四种溶液,在生成的白色沉淀Mg(OH)2中分别加入HNO3和NH4Cl溶液,发现沉淀均溶解.有以下两种解释,同时提供下表数据:
A.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+水解产生H+的缘故.
B.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+结合OH-的缘故.
| 电解质 | HF | HCOOH | CH3COOH | HCN | NH3?H2O |
| 电离度 | 8.00% | 7.16% | 1.32% | 0.01% | 1.33% |
解:(1)因为NH4Cl、HNO3不能与其他物质反应生成沉淀,故X与NaOH和Ba(NO3)2反应生成白色沉淀,实质就是X中的金属离子和氢氧根能结合成白色沉淀,X中的酸根离子和钡离子结合成沉淀,故X应该是CuSO4,生成的白色沉淀是硫酸钡,所以B是硝酸钡,蓝色沉淀是氢氧化铜,所以D是氢氧化钠,氢氧化铜溶于硝酸,硫酸钡不溶于硝酸,所以C是硝酸,即由此可推断则A是NH4Cl,电子式为: ;B是Ba(NO3)2,C是HNO3,D是NaOH,X是CuSO4.
;B是Ba(NO3)2,C是HNO3,D是NaOH,X是CuSO4.
故答案为:Ba(NO3)2; ;
;
(2)硫酸铜中介入过量的氨水的反应实质是:Cu2++4NH3?H2O=Cu(NH3)42++4H2O,故答案为:Cu2++4NH3?H2O=Cu(NH3)42++4H2O;
(3)①第一种溶液中反应后溶液呈黄色,说明其中含有铁元素,第二种溶液中有白色沉淀产生,说明其中含有硫酸根离子,第三种溶液中有能使湿润的红色石蕊试纸变蓝的气体产生,说明其中含有铵根,即Y为:(NH4)2Fe(SO4)2,硝酸具有氧化性,可以将亚铁离子氧化为三价,所以Y溶液与稀硝酸反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,
故答案为:(NH4)2Fe(SO4)2;3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
②若用明矾鉴别上述四种物质,则硫酸根可以和钡离子反应,即:Ba2++SO42-=BaSO4↓,铝离子可以和氢氧根反应,即Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
③CH3COONH4是一种中性的盐,能电离出铵根和醋酸根离子,加入到Mg(OH)2中,若果沉淀溶解,则B正确,如果不溶解,则A正确,故答案为:CH3COONH4.
分析:(1)根据物质间的相互反应及反应现象推断,物质X与这四种物质分别混合能生成两种白色沉淀,NH4Cl、HNO3不能与其他物质反应生成沉淀,沉淀是由NaOH和Ba(NO3)2和X反应生成的,那么白色沉淀就是一种不溶性碱和钡盐;不溶性碱能溶于硝酸,硫酸钡不溶于硝酸;
(2)硫酸铜可以和氨水反应生成硫酸铵和氢氧化铜;
(3)①根据实验的现象确定Y中含有的元素或离子;
②明矾中含有硫酸根和铝离子,根据其发生的反应来回答;
③醋酸铵是一种水解显中性的盐,含有铵根离子.
点评:本题属于物质的鉴别,为了确定物质的组成,通过设计的实验步骤中不同的现象,从而得出正确的结论,要根据它们的性质选择所用的试剂,然后由现象得出结论,综合性强,难度大.
 ;B是Ba(NO3)2,C是HNO3,D是NaOH,X是CuSO4.
;B是Ba(NO3)2,C是HNO3,D是NaOH,X是CuSO4.故答案为:Ba(NO3)2;
 ;
;(2)硫酸铜中介入过量的氨水的反应实质是:Cu2++4NH3?H2O=Cu(NH3)42++4H2O,故答案为:Cu2++4NH3?H2O=Cu(NH3)42++4H2O;
(3)①第一种溶液中反应后溶液呈黄色,说明其中含有铁元素,第二种溶液中有白色沉淀产生,说明其中含有硫酸根离子,第三种溶液中有能使湿润的红色石蕊试纸变蓝的气体产生,说明其中含有铵根,即Y为:(NH4)2Fe(SO4)2,硝酸具有氧化性,可以将亚铁离子氧化为三价,所以Y溶液与稀硝酸反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,
故答案为:(NH4)2Fe(SO4)2;3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
②若用明矾鉴别上述四种物质,则硫酸根可以和钡离子反应,即:Ba2++SO42-=BaSO4↓,铝离子可以和氢氧根反应,即Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
③CH3COONH4是一种中性的盐,能电离出铵根和醋酸根离子,加入到Mg(OH)2中,若果沉淀溶解,则B正确,如果不溶解,则A正确,故答案为:CH3COONH4.
分析:(1)根据物质间的相互反应及反应现象推断,物质X与这四种物质分别混合能生成两种白色沉淀,NH4Cl、HNO3不能与其他物质反应生成沉淀,沉淀是由NaOH和Ba(NO3)2和X反应生成的,那么白色沉淀就是一种不溶性碱和钡盐;不溶性碱能溶于硝酸,硫酸钡不溶于硝酸;
(2)硫酸铜可以和氨水反应生成硫酸铵和氢氧化铜;
(3)①根据实验的现象确定Y中含有的元素或离子;
②明矾中含有硫酸根和铝离子,根据其发生的反应来回答;
③醋酸铵是一种水解显中性的盐,含有铵根离子.
点评:本题属于物质的鉴别,为了确定物质的组成,通过设计的实验步骤中不同的现象,从而得出正确的结论,要根据它们的性质选择所用的试剂,然后由现象得出结论,综合性强,难度大.

练习册系列答案
相关题目
 (2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题:
(2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题: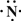 →
→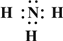
 (1)在一烧杯中盛有稀H2SO4 溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,(如图).向该烧杯里缓缓注入与稀H2SO4 等密度的Ba(OH)2 溶液至恰好完全反应.则在此实验过程中:①烧杯里观察到的现象为
(1)在一烧杯中盛有稀H2SO4 溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,(如图).向该烧杯里缓缓注入与稀H2SO4 等密度的Ba(OH)2 溶液至恰好完全反应.则在此实验过程中:①烧杯里观察到的现象为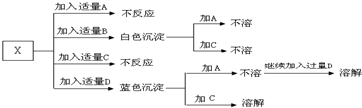 A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种.现利用另一种常见溶液X,用下图所示的方法,可将它们一一确定.请回答以下问题:
A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种.现利用另一种常见溶液X,用下图所示的方法,可将它们一一确定.请回答以下问题: