题目内容
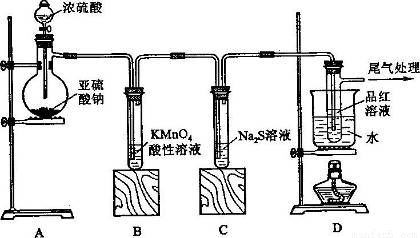
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是_________,其中发生反应的化学方程式_______________________;
(2)实验过程中,装置B、C中发生的现象分别是____________、___________,装置B中发生反应的离子方程式为_________________________________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象________________________;
(4)尾气可采用___________________溶液吸收。
(1)蒸馏烧瓶 Na2SO3 + H2SO4(浓)= Na2SO4 + SO2↑+ H2O
(2)溶液由紫红色变为无色 无色溶液中出现黄色浑浊 5SO2 + 2MnO4-+ 2H2O= 2Mn2+ + 5SO42- + 4H+
(3)品红溶液褪色后,关闭分液漏斗旋塞,点燃酒精灯加热,溶液又恢复为红色 。
(4)NaOH
【解析】
试题分析:(1)在蒸馏烧瓶中发生反应的化学方程式为Na2SO3 + H2SO4(浓)= Na2SO4 + SO2↑+ H2O.(2) 实验过程中,装置A是制取SO2气体,B是验证SO2气体的还原性,现象是KMnO4紫色溶液变浅或褪色,发生反应的离子方程式为5SO2 + 2MnO4-+ 2H2O= 2Mn2+ + 5SO42- + 4H+ ;C验证SO2气体的氧化性,现象是产生淡黄色沉淀。(3)装置D的目的是探究SO2与品红作用的可逆性,实验操作及现象是通入SO2气体,品红溶液褪色,然后关闭分液漏斗旋塞,点燃酒精灯加热,溶液又恢复为红色 。就证明了SO2气体的漂白是不稳定的。(4)因为SO2气体是酸性气体,能与NaOH溶液发生反应,所以尾气可采用通入到NaOH溶液的方法来处理。
考点:考查SO2气体实验室制法、性质的检验、尾气的处理的知识。

 阅读快车系列答案
阅读快车系列答案