题目内容
【题目】硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)锌离子的电子排布式是_____________。
(2)根据元素周期律,电负性S______Se,第一电离能Se________As(填“>”或“<”)。
(3)H2O的沸点______________(填“>”或“<”)H2Se的沸点,其原因是:______。
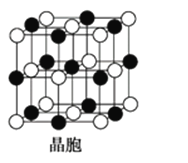
(4)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于______。若已知铜的原子半径为d厘米,表示原子空间占有率的代数式为_____________

(5)A是短周期中原子半径最大的元素; C是A所在周期电负性最大的元素;A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图。
晶胞中距离一个A+最近的C-围成的图形是______________(写名称),若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,晶体中距离最近的两个A+之间的距离为________cm(用含NA与ρ的式子表达)。
【答案】 1s22s22p63s23p63d10或[Ar]3d10 > < > H2O分子间存在氢键 面心立方堆积 ![]() 正八面体
正八面体 ![]()
【解析】(1)Zn是30号元素,其原子核外有30个电子,其3d、4s电子为其价电子,其价电子排布式为![]() ,正确答案:
,正确答案:![]() 。
。
(2)同一主族元素,元素电负性随着原子序数增大而减小,所以电负性![]() ;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能
;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能![]() ;正确答案:> ; <。
;正确答案:> ; <。
(3)含有氢键的氢化物熔沸点较高,![]() 含有氢键、
含有氢键、![]() 不含氢键,导致
不含氢键,导致![]() 的沸点(100℃)高于
的沸点(100℃)高于![]() 的沸点
的沸点![]() ℃);正确答案:> ; H2O分子间存在氢键。
℃);正确答案:> ; H2O分子间存在氢键。
(4)由铜晶体中铜原子的堆积方式图可以知道,铜晶体中原子的堆积模型属于面心立方密堆积;根据图片知,铜单质为面心立方最密堆积,铜原子配位数![]() ,铜的原子半径为d厘米,晶胞的边长为
,铜的原子半径为d厘米,晶胞的边长为 ,每个铜晶胞中含有4个原子,则铜原子总体积为
,每个铜晶胞中含有4个原子,则铜原子总体积为![]() ,晶胞体积为
,晶胞体积为![]() ,故空间利用率为
,故空间利用率为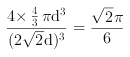 ;正确答案:面心立方堆积 ;
;正确答案:面心立方堆积 ;![]() 。
。
(5)A是短周期中原子半径最大的元素,A 为钠元素;C是A所在周期电负性最大的元素,C为氯元素;由Na、Cl两元素形成的化合物为NaCl,以中间的黑色球为Na+离子研究,与之最近的氯离子有6个,这些氯离子围成的图形是正八面体;晶胞中Na+离子数目=1+12×![]() =4,Cl-离子数目=8×
=4,Cl-离子数目=8×![]() +6×
+6×![]() =4,故晶胞质量=
=4,故晶胞质量=![]() g,晶胞体积=[
g,晶胞体积=[![]() g÷ρ]cm3=
g÷ρ]cm3=![]() cm3,设晶胞棱长为r cm,则 r=
cm3,设晶胞棱长为r cm,则 r= ![]() ,晶体中距离最近的两个Na+之间的距离为
,晶体中距离最近的两个Na+之间的距离为![]() r=
r= ![]() ;正确答案:
;正确答案: ![]() 。
。

 名校课堂系列答案
名校课堂系列答案