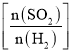��Ŀ����
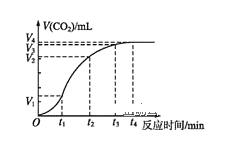
����Ŀ����1��ͼ����ʾ��Ӧ��__(��������������������)��Ӧ���÷�Ӧ����H��__(�ú�E1��E2�Ĵ���ʽ��ʾ)��

��2����֪�Ȼ�ѧ����ʽ��H2(g)��![]() O2(g)=H2O(g) ��H����241.8kJ/mol���÷�Ӧ�Ļ��Ϊ167.2kJ/mol�������淴Ӧ�Ļ��Ϊ___��
O2(g)=H2O(g) ��H����241.8kJ/mol���÷�Ӧ�Ļ��Ϊ167.2kJ/mol�������淴Ӧ�Ļ��Ϊ___��
��3��������ʵ��д�����з�Ӧ���Ȼ�ѧ����ʽ��
��2molH2��2molI2������ȫ��Ӧʱ�����ɵ⻯�����壬�ų���29.8KJ������___��
��1�˼�����ȫȼ�����ɶ�����̼��Һ̬ˮ�ų���akJ���ȣ�д������ȼ���ȵ��Ȼ�ѧ����ʽ��__��
��4���к��ȵIJⶨʵ��Ĺؼ���Ҫ�Ƚ�ȷ������һ�������ʵ���Ũ�ȵ���Һ����ʵ�������Ҫ��������������ɢʧ��Ҫ��Ƚ�ȷ�ز�������Ӧǰ����Һ�¶ȵı仯���ش��������⣺

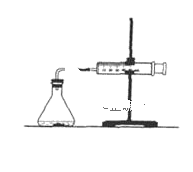
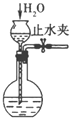
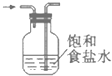
�ٴ�ʵ��װ��ͼ����ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��___��
���ڴ�С�ձ�֮����������ĭ����ֽ������������__��
�۸�ʵ�鳣��0.50mol��L-1HCl��0.55mol��L-1��NaOH��Һ��50mL������NaOH��Ũ���Դ��ԭ��__��
���𰸡����� (E1E2)kJmol1 409.0kJ/mol H2(g)+I2(g)=2HI(g) ��H=-14.9kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(l) ��H=-16a kJ/mol ���β�������� ���£����� ��֤������ȫ���к�
��������
��1������ͼ�������Ӧ��������������������������Ӧ���ȣ��ڻ�ѧ��Ӧ�У���Ӧ���ʱ���H=�������������-��Ӧ�����������
��2����Ӧ�Ļ����ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ�����������ͼ��������ϵ��֪���淴Ӧ�Ļ��=����Ӧ�Ļ��+��Ӧ�ʱ�ľ���ֵ��
��3����2mol H2��2mol I2������ȫ��Ӧʱ������4mol HI���壬��1mol������1mol��������Ӧ����2mol HI����14.9KJ��
��ȼ������ָ1mol��ȼ����ȫȼ�������ȶ�������ʱ���ų���������
��4���ٸ������ȼƵĹ������жϸ�װ�õ�ȱ��������
���к��Ȳⶨʵ��ɰܵĹؼ��DZ��¹�����
��NaOH��Ũ�ȴ���HCl��Ũ�ȣ�ʹ������ȫ���кͣ��Ӷ�����������ʵ�����������ˮ�����ʵ��������������к��ȡ�
��1������ͼ���������Ӧ������������������������������Ӧ���ȣ��ڻ�ѧ��Ӧ�У���Ӧ���ʱ���H=���������������Ӧ���������������H=(E2E1)kJmol1= (E1E2)kJmol1��
�ʴ�Ϊ�����ȣ� (E1E2)kJmol1��
��2����Ӧ�Ļ����ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ�����������ͼ��������ϵ��֪���淴Ӧ�Ļ��=����Ӧ�Ļ��+��Ӧ�ʱ�ľ���ֵ��H2(g)��![]() O2(g)=H2O(g) ��H����241.8kJ/mol���÷�Ӧ�Ļ��Ϊ167.2 kJ/mol�������淴Ӧ�Ļ��=167.2kJ/mol+241.8kJ/mol=409.0kJ/mol��
O2(g)=H2O(g) ��H����241.8kJ/mol���÷�Ӧ�Ļ��Ϊ167.2 kJ/mol�������淴Ӧ�Ļ��=167.2kJ/mol+241.8kJ/mol=409.0kJ/mol��
�ʴ�Ϊ��409.0kJ/mol��
��3����2mol H2��2mol I2������ȫ��Ӧʱ������4mol HI���壬��1mol������1mol��������Ӧ����2mol HI����14.9kJ�����Ȼ�ѧ����ʽΪ��H2(g)+I2(g)=2HI(g) ��H=-14.9kJ/mol��
�ʴ�Ϊ��H2(g)+I2(g)=2HI(g) ��H=-14.9kJ/mol��
��1�˼�����ȫȼ�����ɶ�����̼��Һ̬ˮ�ų���a kJ����������1mol������ȫȼ�շ���16a kJ�������ȼ���ȵ��Ȼ�ѧ����ʽΪ��CH4(g)+2O2(g)=CO2(g)+2H2O(l) ��H=-16a kJ/mol��
�ʴ�Ϊ��CH4(g)+2O2(g)=CO2(g)+2H2O(l) ��H=-16a kJ/mol��
��4���ٴ�ʵ��װ��ͼ����ͼ����ȱ�ٵ�һ�ֲ�����Ʒ�ǻ��β����������
�ʴ�Ϊ�����β����������
���к��Ȳⶨʵ��ɰܵĹؼ��DZ��¹�������С�ձ�֮��������ֽ���������DZ��¡����ȣ�����ʵ������е�������ʧ��
�ʴ�Ϊ�����£����ȣ�
��NaOH��Ũ�ȴ���HCl��Ũ�ȣ�ʹ������ȫ���кͣ��Ӷ�����������ʵ�����������ˮ�����ʵ��������������к��ȣ�
�ʴ�Ϊ����֤������ȫ���к͡�