题目内容
【题目】化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过反应3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。A在一定条件下通过多步去氢可最终转化为氮化硼(BN)。请回答下列问题:
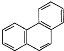
(1)与(HB=NH)3互为等电子体的分子为________(填分子式)
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的结构类似,则其晶体中每个硼原子与____个氮原子相连,每个氮原子与_____个硼原子相连。
(3)人工可以合成硼的一系列氢化物,其物理性质与烷烃相似,故称之为硼烷。工业上采用LiAlH4和BF3在乙醚介质中反应制得乙硼烷(B2H6),同时生成另外两种产物。该反应的化学方程式为___________。
(4)相关化学键的键能如下表所示,简要分析和解释下列事实。
化学键 | B—H | B—O | B—B |
键能(kJ·mol-1) | 389 | 561 | 293 |
自然界中不存在硼单质,硼氢化物也很少,主要是含氧化合物,其原因为____________。
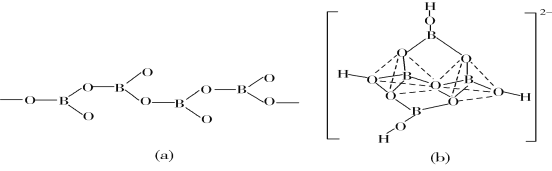
(5)在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式。图(a)为一种无限长单链结构的多硼酸根,其化学式为________;图(b)为硼砂晶体中的阴离子,其中硼原子采取的杂化类型为________。
【答案】C6H6 4 4 3LiAlH4+4BF3![]() 2B2H6+3LiF+3AlF3 B—O键的键能大于B—B键和B—H键,所以更易形成稳定性更强的B—O键
2B2H6+3LiF+3AlF3 B—O键的键能大于B—B键和B—H键,所以更易形成稳定性更强的B—O键 ![]() 或BO
或BO![]() sp2、sp3
sp2、sp3
【解析】
(1)原子数相同,价电子总数相同的分子,互称为等电子体,与(HB=NH)3互为等电子体的分子为C6H6;
(2)根据金刚石的结构( )可以判断出金刚石的一个晶胞中含有的碳原子数为
)可以判断出金刚石的一个晶胞中含有的碳原子数为![]() ,因此立方氮化硼晶胞中应该含有4个N和4个B原子;
,因此立方氮化硼晶胞中应该含有4个N和4个B原子;
(3)LiAlH4和BF3在一定条件下生成乙硼烷B2H6,根据元素守恒,另外两种产物为LiF和AlF3,根据原子守恒配平方程式为:3LiAlH4+4BF3![]() 2B2H6+3LiF+3AlF3;
2B2H6+3LiF+3AlF3;
(4)因为B-O键键能大于B-B键和B-H键,所以更易形成稳定性更强的B-O键,根据键能越大物质越稳定,可知自然界中不存在硼单质,硼氢化物也很少,主要是含氧化物,故答案为B-O键键能大于B-B键和B-H键,所以更易形成稳定性更强的B-O键;
(5)图(a)是一种链状结构的多硼酸根,从图可看出,每个BO32-单元,都有一个B,有一个O完全属于这个单元,剩余的2个O分别为2个BO32-单元共用,所以B:O=1:(1+2×![]() )=1:2,化学式为:
)=1:2,化学式为:![]() 或BO
或BO![]() ,从图(b)是硼砂晶体中阴离子的环状结构可看出,[B4O5(OH)4]2-中间两个硼原子各连接四个氧原子,采取sp3杂化形成两个四配位BO4四面体;另两个硼原子连接三个氧原子,采取sp2杂化形成两个三配位BO3平面三角形结构,所以硼原子的杂化类型为sp2、sp3。
,从图(b)是硼砂晶体中阴离子的环状结构可看出,[B4O5(OH)4]2-中间两个硼原子各连接四个氧原子,采取sp3杂化形成两个四配位BO4四面体;另两个硼原子连接三个氧原子,采取sp2杂化形成两个三配位BO3平面三角形结构,所以硼原子的杂化类型为sp2、sp3。

 名校课堂系列答案
名校课堂系列答案【题目】下列有关实验操作与相应结论都正确的是![]()
选项 | 实验操作及现象 | 实验结论 |
A | 取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润蓝色石蕊试纸变红. | 可证明晶体的成分中含有 |
B | Z、W两试管中分别盛有pH和体积相同的盐酸和醋酸溶液,同时分别投入质量大小、形状相同的少量锌粒,Z中产生气体速率快 | Z中盛放的是醋酸 |
C | 向尿液中加入新制 | 说明尿液中不含有葡萄糖 |
D | 某待测液先滴入氯水无明显现象,后滴入硫氰化钾溶液出现血红色 | 该待测液中一定含有 |
A.AB.BC.CD.D
【题目】在三个体积均为2 L恒容密闭容器中,反应CO(g)+2H2(g)![]() CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
容器编号 | 温度/K | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | ||
CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||
Ⅰ | T1 | 0.40 | 0.80 | 0 | 0.24 |
Ⅱ | T2 | 0 | 0 | 0.40 | 0.20 |
Ⅲ | T2 | a | b | ||
A.反应温度:T1<T2
B.达平衡时,转化率:α(CO,Ⅰ)+α(CH3OH,Ⅱ)>1
C.在容器Ⅲ中,若平衡时,CO的转化率大于H2,则![]()
D.在容器Ⅲ中,若起始时加入0.4 mol CO、0.4 mol H2和0.4 mol CH3OH,则此时v(正)>v(逆)