题目内容
某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种。已知甲、乙及CO、H2的燃烧热如下:
| 物质 | 甲 | 乙 | CO | H2 |
| 燃烧热/kJ/mol | 1 366 | 5 518 | 283 | 286 |
取甲、乙按不同比例混合的燃油23 g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如图所示。试求:
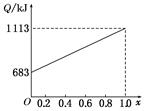
(1)甲、乙的相对分子质量为:Mr(甲)= ,Mr(乙)= 。
(2)1 mol由甲、乙以等物质的量混合而成的燃油在一定量的O2中燃烧,放出热量2 876 kJ,则反应中生成CO mol。
(1)46 114
(2)2
解析

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案用Cl2生产某些含氯有机物时会产生副产物HCl。 利用反应A:4HCl+O2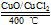 2Cl2+2H2O,
2Cl2+2H2O,
可实现氯的循环利用。
已知:Ⅰ.反应A中,4mol HCl被氧化,放出115.6kJ的热量.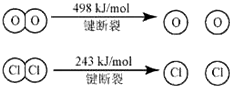
Ⅱ.则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为
| A.16kJ | B.24kJ | C.32kJ | D.48kJ |
下列热化学方程式正确的是( )
A.2SO2+O2 2SO3 ΔH=-196.6 kJ·mol-1 2SO3 ΔH=-196.6 kJ·mol-1 |
| B.C(g)+O2(g)=CO(g) ΔH=393.5 kJ·mol-1 |
C.H2(g)+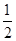 O2(g)=H2O(g) ΔH=-241.8 kJ O2(g)=H2O(g) ΔH=-241.8 kJ |
| D.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 |
有关热化学方程式书写与对应表述均正确的是( )
| A.稀硫酸与0.1 mol·L-1NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l)△H = -57.3 kJ·mol-1 |
| B.在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1, 则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1 |
| C.已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol-1 |
| D.1mol氢气完全燃烧生成液态水放热为285.8kJ,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(g) △ H=-285.8 kJ· mol-1 |
下列说法正确的是( )
| A.需要加热方能发生的反应一定是吸热反应 |
| B.若反应为放热反应,则该反应不必加热就可发生 |
| C.放热反应比吸热反应容易发生 |
| D.化学反应都伴随着能量的变化 |
常温下,已知:
4Al(s)+3O2(g)=2Al2O3(s)ΔH1
4Fe(s)+3O2(g)=2Fe2O3(s)ΔH2
下面关于ΔH1、ΔH2的比较正确的是( )
| A.ΔH1>ΔH2 | B.ΔH1<ΔH2 |
| C.ΔH1=ΔH2 | D.无法计算 |
氯原子对O3分解有催化作用:O3+Cl=ClO+O2 ΔH1,ClO+O=Cl+O2 ΔH2,大气臭氧层的分解反应是:O3+O=2O2 ΔH,该反应的能量变化示意图如图所示,下列叙述中,正确的是( )
| A.反应O3+O=2O2的ΔH=E1-E3 |
| B.反应O3+O=2O2的ΔH=E2-E3 |
| C.O3+O=2O2是吸热反应 |
| D.ΔH=ΔH1+ΔH2 |
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol-1;H2(g)+O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1。CO2气体与H2气体反应生成甲烷气体与液态水的热化学方程式为CO2(g)+4H2(g)=CH4(g)+2H2O(l)ΔH3,其中ΔH3的数值为( )
| A.-252.9 kJ·mol-1 | B.+252.9 kJ·mol-1 |
| C.-604.5 kJ·mol-1 | D.+604.5 kJ·mol-1 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( )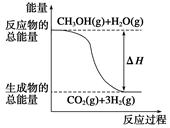
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+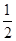 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
| B.反应①中的能量变化如图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据②推知反应:CH3OH(l)+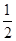 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |