题目内容
(2013?房山区一模)PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放.通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx+CO
N2+CO2下列关于此反应的说法中,不正确的是( )
| 催化剂 |
分析:A、同周期自左而右原子半径减小;
B、x=2时,N元素由NO2中+4价降低为N2中0价,转移电子物质的量为N原子的4倍;
C、N2分子中含有N≡N三键,1molN2含有3mol共价键,CO2分子中含有2个C=O双键,1molCO2含有4mol共价键;
D、根据电子转移守恒计算NOx中N元素的化合价.
B、x=2时,N元素由NO2中+4价降低为N2中0价,转移电子物质的量为N原子的4倍;
C、N2分子中含有N≡N三键,1molN2含有3mol共价键,CO2分子中含有2个C=O双键,1molCO2含有4mol共价键;
D、根据电子转移守恒计算NOx中N元素的化合价.
解答:解:A、同周期自左而右原子半径减小,故原子半径C>N>O,故A正确;
B、x=2时,N元素由NO2中+4价降低为N2中0价,转移电子物质的量为N原子的4倍,每生成1mol N2,转移电子数为1mol×2×4=8mol,故B错误;
C、N2分子中含有N≡N三键,1molN2含有3mol共价键,CO2分子中含有2个C=O双键,1molCO2含有4mol共价键,故等物质的量N2和CO2中,共价键的个数比为3:4,故C正确;
D、令NOx中N元素的化合价为a,则1×(a-0)=1×(4-2),解得a=2,故D正确;
故选B.
B、x=2时,N元素由NO2中+4价降低为N2中0价,转移电子物质的量为N原子的4倍,每生成1mol N2,转移电子数为1mol×2×4=8mol,故B错误;
C、N2分子中含有N≡N三键,1molN2含有3mol共价键,CO2分子中含有2个C=O双键,1molCO2含有4mol共价键,故等物质的量N2和CO2中,共价键的个数比为3:4,故C正确;
D、令NOx中N元素的化合价为a,则1×(a-0)=1×(4-2),解得a=2,故D正确;
故选B.
点评:本题考查原子半径比较、化学键、氧化还原反应计算等,难度中等,注意理解氧化还原反应中电子转移守恒.

练习册系列答案
相关题目
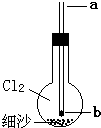 (2013?房山区一模)如图所示实验装置,烧瓶内充满氯气,底部有一层细沙(不参与反应),玻璃导管下口b处塞有一小块钠.从a口伸入一根细铁丝把钠块捅下去,再用滴管从a口滴下一滴水,恰好落在钠块上,立即剧烈反应.下列对此实验的说法中,不正确的是( )
(2013?房山区一模)如图所示实验装置,烧瓶内充满氯气,底部有一层细沙(不参与反应),玻璃导管下口b处塞有一小块钠.从a口伸入一根细铁丝把钠块捅下去,再用滴管从a口滴下一滴水,恰好落在钠块上,立即剧烈反应.下列对此实验的说法中,不正确的是( )