题目内容
【题目】下列图象分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
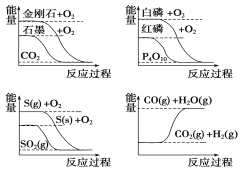
A. 白磷比红磷稳定
B. S(g)+O2(g)===SO2(g) ΔH1,S(s)+O2(g)===SO2(g) ΔH2,则ΔH1>ΔH2
C. CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0
D. 石墨转变为金刚石是吸热反应
【答案】D
【解析】
利用物质能量越低,物质越稳定;反应物总能量大于生成物总能量,则该反应为放热反应,反应物总能量低于生成物总能量,则该反应为吸热反应进行判断;
A、根据白磷与氧气反应、红磷与氧气反应的图象,推出红磷的能量低于白磷,依据能量越低,物质越稳定,得到红磷比白磷稳定,故A错误;
B、硫与氧气反应是放热反应,即△H<0,S(s)=S(g),该过程为吸热过程,即△H1<△H2,故B错误;
C、根据图象,CO(g)和H2O(g)总能量大于CO2(g)与H2(g)总能量,说明该反应为放热反应,即△H<0,故C错误;
D、根据能量关系,石墨的能量低于金刚石,因此石墨转变为金刚石是吸热反应,故D正确。
答案选D。

练习册系列答案
相关题目