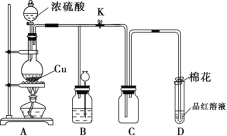
��Ŀ����
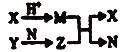
����Ŀ��I.��ͼ�ס��ҡ�����Ϊ��֤ͭ��Ũ���ᷴӦ��װ�ã�

(1)�ס��ҡ�������װ���й�ͬ�����Ļ�ѧ����ʽ��___________________��
(2)�ͼ�װ����ȣ���װ�õ��ŵ���
��________________________________________________��
��_______________________________________________��
(3)Ϊ�˽�һ����֤NO2��ˮ�ķ�Ӧ��ijѧ������˱�װ�á�ʵ��ʱ�ȹرջ���c���ٴ���a��b������ʹNO2����������Թܣ�������������Թܺ�ͭ˿��������Һ���롣��ʹ�ձ��е�ˮ������Թܣ�Ӧ����β���_________________��
(4)���Թ��е�NO2��ˮ��ַ�Ӧ��������Һ���ʵ���Ũ�ȵ����ֵ��_____mol/L (�����������״������)��
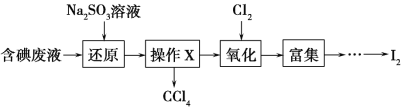
II.֤��±��Ԫ�صķǽ�����ǿ����ijС������ͼ��ʾװ�ý���ʵ��(�г���������ȥ�������Լ��)

ʵ����̣���.���ɼУ�����a���μ�Ũ���ᡣ
��.��B��C�е���Һ����Ϊ��ɫʱ���н����ɼС�
��.��B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ���رջ���a�� ��.����
(1)��֤������������ǿ�ڵ��ʵ��������________________________________________��
(2)B����Һ������Ӧ�����ӷ���ʽ��____________________________________��
(3)Ϊ��֤���������ǿ�ڵ⣬���� �� �IJ�����������__________________��
(4)�ȡ��塢�ⵥ�ʵ�������������ԭ��ͬ����Ԫ�ش��ϵ��£�ԭ�Ӱ뾶��________���õ���������________��
���𰸡�Cu��4HNO3(Ũ)��Cu(NO3)2��2NO2����2H2O ���Կ��Ʒ�Ӧ�ķ�����ֹͣ ���ն����������壬��ֹ������Ⱦ �ȹر�b���ٹر�a��Ȼ���c��������ס�Թܢ� 1/22.4 ���۵⻯����ֽ���� 2Br��+Cl2��Br2+2Cl�� ����b��������C����Һ����D�У��رջ���b��ȡ��D����ֹ�����Ȼ�̼����Һ��Ϊ�Ϻ�ɫ ���� ����
��������
I.��1��ͭ��Ũ���ᷴӦ��������ͭ������������ˮ���ݴ���д��
��2�����ݷ�Ӧ�ɿ��ƣ���ʱ����ֹͣ�Լ��Ƿ����������Ⱦ�������
��3����ʹ�ձ��е�ˮ������Թܣ���Ҫ�ö���������ˮ�Ӵ����ݴ��жϣ�
��4��������������ˮ���������NO���ݴ˼��㡣
��.װ��A�Ǹ����������Ũ�������������������͵⻯�ط�Ӧ���ɵ��ʵ⣬������������ɫ�����ɵ�����ͨ��װ��B�к��廯�Ʒ�Ӧ���ɵ����壬֤������������ǿ���壬��ͨ��װ��C�ų����������û����ʵ����ţ��ݴ˽��
I.��1���ס��ҡ�������װ���й�ͬ�����ķ�Ӧ��Ũ������������ͭ����Ӧ�Ļ�ѧ����ʽ��Cu��4HNO3(Ũ)��Cu(NO3)2��2NO2����2H2O��
��2���ͼ�װ����ȣ���װ����ʹ��Ӧ�ɿ��ƣ�ͨ���ƶ�ͭ˿����ʱ����ֹͣ��Ӧ���Ƚ�ʡ��Դ�ֱ����˻�����ͬʱ���ղ����Ķ����������壬��ֹ������Ⱦ��
��3��Ϊ��NO2����������Թܣ��ȹرջ���c���ٴ���a��b��Ϊ���ö���������ˮ��ֽӴ�������Ӧ��Ӧ�ȹر�b���ٹر�a��Ȼ���c��������ס�Թܢڼ��ɣ�
��4�����Թܵ��ݻ���VL������ݷ���ʽ3NO2��H2O��2HNO3��NO��֪������Һ���ʵ���Ũ�ȵ����ֵ��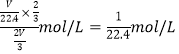 ��
��
��.��1�������������Ũ�������������������ѵ⻯������Ϊ���ʵ⣬����֤������������ǿ�ڵ��ʵ�������ǵ��۵⻯����ֽ������
��2�����ɵ�����ͨ��Bװ���а��廯������Ϊ�����壬��B����Һ������Ӧ�����ӷ���ʽ��2Br��+Cl2��Br2+2Cl����
��3������Ҫ�ų����������û����ʵ����ţ���Ϊ��֤���������ǿ�ڵ⣬���̢��IJ����������Ǵ���b��������C����Һ����D�У��رջ���b��ȡ��D����ֹ�����Ȼ�̼����Һ��Ϊ�Ϻ�ɫ��
��4���ȡ��塢�ⵥ�ʵ�������������ԭ��ͬ����Ԫ�ش��ϵ��£�ԭ�Ӱ뾶�����õ�������������

 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д�