题目内容
相同条件下,质量相同的NH3和CH4,下列说法正确的是
| A.密度比为16:17 | B.氢原子比为3:4 |
| C.物质的量比为1:1 | D.体积比为16:17 |
B
解析试题分析:A、根据ρ=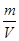 =
=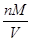 =
= 知,相同条件下,气体摩尔体积相同,气体的密度与相对分子质量成正比,所以其密度之比=17:16,故A错误;B、相同条件下,等体积的氨气和甲烷的物质的量相同,一个氨气分子中含有3个H,一个甲烷分子中含有4个H,所以所含氢原子物质的量之比为3:4,故B正确;C、根据n=
知,相同条件下,气体摩尔体积相同,气体的密度与相对分子质量成正比,所以其密度之比=17:16,故A错误;B、相同条件下,等体积的氨气和甲烷的物质的量相同,一个氨气分子中含有3个H,一个甲烷分子中含有4个H,所以所含氢原子物质的量之比为3:4,故B正确;C、根据n= 知,在质量相同的情况下,物质的量比为相对分子质量的反比,即物质的量比为16:17,故C错误;D、n=
知,在质量相同的情况下,物质的量比为相对分子质量的反比,即物质的量比为16:17,故C错误;D、n= =
= 知,在相同条件下,气体的Vm相等,即体积之比等于相对分子质量之比,所以体积之比=17:16,故D错误。
知,在相同条件下,气体的Vm相等,即体积之比等于相对分子质量之比,所以体积之比=17:16,故D错误。
考点:阿伏加德罗常数;物质分子中原子个数计算;物质的量的相关计算

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
实验室需配制450 ml 0.1 mol/L的Na2CO3溶液,以下操作正确的是( )
| A.称取4.77 g Na2CO3固体溶于水配成450 mL溶液 |
| B.称取5.3 g Na2CO3固体溶于水配成500 mL溶液 |
| C.称取12.9 g Na2CO3·10H2O 固体溶于水配成450mL溶液 |
| D.量取90 mL 0.5mol/L Na2CO3溶液加360mL水稀释 |
下列化学用语的表述正确的是
A.离子结构示意图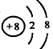 :可以表示16O2-,也可以表示18O2- :可以表示16O2-,也可以表示18O2- |
B.比例模型 :可以表示甲烷分子,也可以表示四氯化碳分子 :可以表示甲烷分子,也可以表示四氯化碳分子 |
C.氯化铵的电子式为: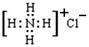 |
D.CO2的结构式为: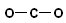 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A.28g氮气所含有的原子数目为NA |
| B.化学反应中1mol金属镁变成镁离子时失去电子数目为2NA |
| C.标准状况下,22.4L水中含有NA个水分子 |
| D.标准状况下,22.4L氯化氢所含的原子数为NA |
用NA表示阿佛加德罗常数,下列叙述中正确的是
| A.常温常压下,22.4 L的氧气含氧原子数为2NA |
| B.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| C.常温下,23g NO2含有NA个氧原子 |
| D.足量铜与1L 18mol·L-1浓硫酸反应可以得到SO2的分子总数为9NA |
某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
| A.1∶2 | B.1∶4 | C.3∶4 | D.3∶2 |
下列化学用语正确的是
A.中子数为20的氯原子: |
| B.硫酸的电离方程式:H2SO4=H2++SO42— |
| C.漂白粉的有效成分:CaCl2 |
| D.明矾的化学式:KAl(SO4)2?12H2O |
下列化学用语只能用来表示一种微粒的是
A. | B.2s22p6 | C.CH4O | D.C |
在V mL Al2(SO4)3溶液中含有Al3+m g,取V/4 mL该溶液用水稀释至4V mL,则SO42-物质的量浓度为
A.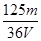 mol/L mol/L | B.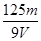 mol/L mol/L | C. mol/L mol/L | D.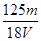 mol/L mol/L |