题目内容
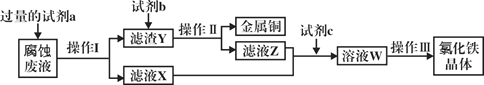
【题目】水溶液中只可能有K+、Mg2+、AlO2﹣、SiO32﹣、CO32﹣、SO42﹣中的若干种离子.某同学对溶液进行了如图实验:下列判断错误的是( )

A. 有气体甲生成,表明溶液X中一定含有CO32﹣
B. 沉淀甲可能是硅酸镁
C. K+一定存在于溶液X中
D. 不能确定SO42﹣是否存在于溶液X中
【答案】B
【解析】
加HCl有气体说明有CO32﹣离子,生成的气体是二氧化碳,一定不存在和碳酸根发生反应的离子,所以不存在镁离子、铝离子,加盐酸有沉淀,说明一定有硅酸根离子,硅酸是沉淀,加入过量氨水提供OH-有沉淀生成,只能是氢氧化铝沉淀,说明此时溶液中存在铝离子,但是原来溶液中的铝离子一定不能存在,所以该铝离子是偏铝酸根离子和盐酸反应生成的,所以,一定存在偏铝酸根离子,要保证溶液电中性,只有K+这一个阳离子,所以一定存在钾离子。
A、加HCl有气体说明有CO32﹣离子,生成的气体是二氧化碳,所以A选项是正确的;B、溶液中含有离CO32﹣离子,则一定不含有镁离子,因为CO32﹣离子和镁离子不能大量共存,所以沉淀甲是硅酸,不可能是硅酸镁,所以B是错误的;C、原来溶液中的铝离子一定不能存在,该铝离子是偏铝酸根离子和盐酸反应生成的,所以,一定存在偏铝酸根离子,要保证溶液电中性,一定存在钾离子,故C正确;D、硫酸根离子是否存在不能确定,所以D是正确的。所以答案为B。

【题目】下表中对应关系正确的是
A | CH3CH3+Cl2 | 均为取代反应 |
B | 由油脂得到甘油 | 均发生了水解反应 |
C | Cl2+2Br=2Cl+Br2 | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O+4NaOH+O2↑ | 均为水作还原剂的氧化还原反应 |
【题目】对分别盛有不同无色溶液①②③④四支试管进行如下操作,现象和结论对应正确的是
操作 | 现象 | 结论 | |
A | 向①中先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
B | 向②(盛KI淀粉溶液)中通入少量的Cl2 | 溶液变蓝色 | Cl2与淀粉发生显色反应 |
C | 向③中溶液先滴加H2O2溶液,再滴加KSCN溶液 | 溶液变红色 | 原溶液中含有Fe2+ |
D | 向④中滴加浓NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
A. A B. B C. C D. D