题目内容
已知某粒子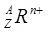 ,则元素R的原子序数是( )。
,则元素R的原子序数是( )。
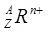 ,则元素R的原子序数是( )。
,则元素R的原子序数是( )。| A.Z | B.A-Z | C.Z-n | D.Z+n |
A
试题分析:
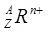 表示质子数为Z。质量数为A,带有n个正电荷的阳离子。因此元素R的原子序数是Z。选项为A。
表示质子数为Z。质量数为A,带有n个正电荷的阳离子。因此元素R的原子序数是Z。选项为A。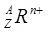 各个角标的含义的知识。
各个角标的含义的知识。
练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
题目内容
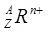 ,则元素R的原子序数是( )。
,则元素R的原子序数是( )。| A.Z | B.A-Z | C.Z-n | D.Z+n |
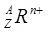 表示质子数为Z。质量数为A,带有n个正电荷的阳离子。因此元素R的原子序数是Z。选项为A。
表示质子数为Z。质量数为A,带有n个正电荷的阳离子。因此元素R的原子序数是Z。选项为A。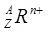 各个角标的含义的知识。
各个角标的含义的知识。
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案