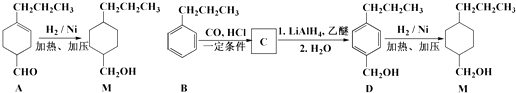
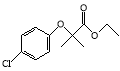
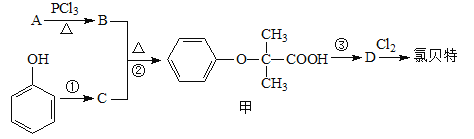
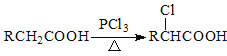
题目内容
【题目】R、Q、X、Y、Z是原子序数依次增大的五种短周期主族元素,R与Q形成的气态化合物的水化物显碱性,X、Y、Z三种元素族序数之和为10,Y单质能与强碱溶液反应,Z元素原子最外层电子数是电子层数的两倍。
(1)Z在周期表中的位置_______________;X、Y、Z三种元素形成的简单离子半径由大到小的顺序是________________________。(用离子符号回答)
(2)X和R两种元素按原子个数比1:1组成的化合物的电子式为____________。
(3)写出Y、Z两种元素最高价氧化物对应的水化物相反应的离子方程式:_____________。
(4)水的沸点远高于Z元素的氢化物的沸点,原因是_________________。
(5)Q4是一种Q元素的新单质,可用作推进剂或炸药,推算其分子中含有_____对共用电子。
(6)由R、Q两元素组成的一种液态化合物W常用作还原剂,W分子中含有18个电子,W分子的结构式为_____________________。W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为_____________________。
【答案】 第三周期第ⅥA族 S2->Na+>Al3+ ![]() Al(OH)3+3H+=Al3++3H2O 水分子之间形成氢键 6
Al(OH)3+3H+=Al3++3H2O 水分子之间形成氢键 6 ![]() 4Cu(OH)2+N2H4=2Cu2O+N2↑+6H2O
4Cu(OH)2+N2H4=2Cu2O+N2↑+6H2O
【解析】R、Q、X、Y、Z是原子序数依次增大的五种短周期元素,R与Q形成的气态化合物的水化物显碱性,所以R是H元素,Q是N元素;X、Y、Z三种元素族序数之和为10,Y单质能与强碱溶液反应,则Y是Al元素,Z元素原子最外层电子数是电子层数的两倍,则Z是S元素,所以X元素的族序数是10-3-6=1,X是Na元素,据此解答。
根据以上分析可知R是H,Q是N,X是Na,Y是Al,Z是S。则
(1)Z是S元素,在周期表中的位置是第三周期第ⅥA族;X、Y、Z三种元素形成的简单离子半径分别是Na+、Al3+、S2-,对于电子层数相同的元素来说,核电荷数越大,离子半径越小;对于电子层数不同的离子来说,离子核外电子层数越多,离子半径就越大,所以三种离子的半径由大到小的顺序是S2->Na+>Al3+;
(2)X和R两种元素按原子个数比1:1组成的化合物是NaH,该物质是离子化合物,电子式为![]() ;
;
(3)Y、Z两种元素最高价氧化物对应的水化物分别是Al(OH)3、H2SO4,前者是两性氢氧化物,可以与强酸硫酸发生反应生成硫酸铝和水,二者反应的离子方程式为Al(OH)3+3H+=Al3++3H2O。
(4)由于水分子之间存在氢键,增加了分子之间的吸引力,使物质的熔沸点升高,因此水的沸点远高于Z元素的氢化物H2S的沸点;
(5)N4是一种N元素的新单质,可用作推进剂或炸药,根据同族元素形成的物质结构的相似性,与P4类似,P4分子中有6个共价键,推算其分子中含有6对共用电子。
(6)由R、Q两元素组成的一种液态化合物W常用作还原剂,W分子中含有18个电子,W分子是N2H4,分子的结构式为![]() 。W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质N2,则根据原子守恒、电子守恒可得该反应的化学方程式为4Cu(OH)2+N2H4=2Cu2O+N2↑+6H2O。
。W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质N2,则根据原子守恒、电子守恒可得该反应的化学方程式为4Cu(OH)2+N2H4=2Cu2O+N2↑+6H2O。