题目内容
【题目】常温下,向20mLxmol/LCH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如下图所示(忽略温度变化)。下列说法中不正确的是
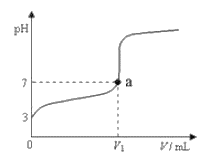
A. 上述CH3COOH溶液中:c(H+)=1×10-3mol/L
B. 图中V1<20mL
C. a点对应的溶液中,c(CH3COO-)=c(Na+)
D. 当加入NaOH溶液的体积为20mL时,溶液中:c(CH3COOH)+c(H+)>c(OH-)
【答案】D
【解析】
A、由图像可知,加入氢氧化钠溶液之前,醋酸pH=3说明c(H+)=1×10-3mol/L,故A正确;B、若物质的量浓度都是xmol/L的醋酸与氢氧化钠溶液等体积混合,则混合后恰好反应生成醋酸钠,醋酸钠为强碱弱酸盐水解呈碱性,如呈中性,加入氢氧化钠溶液体积需小于20mL,故B正确;C、溶液中存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+),a点对应的溶液c(OH-)=c(H+),则c(CH3COO-)=c(Na+),故C正确;D、当加入氢氧化钠溶液的体积为20mL时,恰好反应生成醋酸钠,溶液中存在物料守恒,c(CH3COO-)+c(CH3COOH)=c(Na+),溶液中也存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+),因此c(CH3COOH)+c(H+)=c(OH-),故D错误;故选D。

【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) △H=一92.6kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g) △H=一92.6kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述不正确的是( )
A. 容器①、②中反应的平衡常数相等
B. 平衡时,两个容器中NH3的体积分数均为1/7
C. 容器②中达平衡时放出的热量Q=23.15kJ
D. 若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ