题目内容
(10分)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是同周期中非金属性最强的元素。
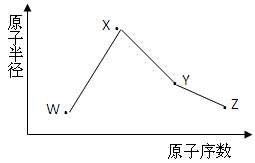
(1)W原子的结构示意图为_______________。
(2)X位于元素周期表第_____周期第_____族。
(3)Y的最高价氧化物对应的水化物的化学式为__________。
(4)Z单质与溴单质相比,更易与氢气发生化合反应的是______(写化学式)。
(5)X与W能形成两种化合物,其化学式为________ 、________。

(1)W原子的结构示意图为_______________。
(2)X位于元素周期表第_____周期第_____族。
(3)Y的最高价氧化物对应的水化物的化学式为__________。
(4)Z单质与溴单质相比,更易与氢气发生化合反应的是______(写化学式)。
(5)X与W能形成两种化合物,其化学式为________ 、________。
(1) 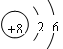 (2分) (2)三;ⅠA(2分)
(2分) (2)三;ⅠA(2分)
(3)H2SiO3(2分) (4)Cl2(2分) (5)Na2O、Na2O2(2分)
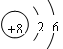 (2分) (2)三;ⅠA(2分)
(2分) (2)三;ⅠA(2分) (3)H2SiO3(2分) (4)Cl2(2分) (5)Na2O、Na2O2(2分)
W的一种核素的质量数为18,中子数为10,则W思维原子序数是8,即W是O。X和Ne原子的核外电子数相差1,且X的原子半径最大,所以X是Na。Y的单质是一种常见的半导体材料,所以Y是Si。Z是同周期中非金属性最强的元素,又因为Z的原子半径大于O的原子半径,所以Z是Cl,非金属性强于溴的,和氢气更容易化合。

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
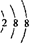 ,则该微粒一定是氩原子
,则该微粒一定是氩原子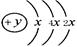 ;B、C可形成离子化合物B3C2,
;B、C可形成离子化合物B3C2,