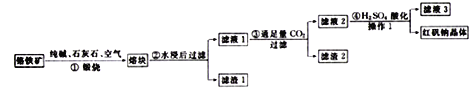
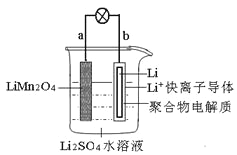
题目内容
【题目】可逆反应A(g)+3B(g)2C(g)△H=﹣QkJ/mol.有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2 . 下列叙述正确的是( )
A.乙中C的转化率为75%
B.反应.达到平衡前,甲中始终有V正>V逆 , 乙中始终有V正<V逆
C.在该条件下,反应2C(g)A(g)+3B(g)的平衡常数为2.7×1.54
D.乙中的热化学方程式为2C(g))A(g)+3B(g)△H=+Q2kJ/mol
【答案】B
【解析】A.乙中反应掉的C为 ![]() xmol=
xmol= ![]() =0.5mol,C的转化率为
=0.5mol,C的转化率为 ![]() ×100%=25%,A不符合题意;
×100%=25%,A不符合题意;
B.甲中反应正向进行建立平衡,乙中逆向进行建立平衡,故反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正小于v逆,B符合题意;
C.由A分析可知平衡时乙中C为0.5mol,故:
2C(g) | A(g)+ | 3B(g) | |
起始(mol) | 2 | 0 | 0 |
转化(mol) | 0.5 | 0.25 | 0.75 |
平衡(mol) | 1.5 | 0.25 | 0.75 |
故平衡常数K= ![]() ,因容器的体积未知,所以无法求算具体数值,C不符合题意;
,因容器的体积未知,所以无法求算具体数值,C不符合题意;
D.可逆反应不能完全反应,2molC完全分解吸收的热量大于Q2kJ,由A中分析可知,2molC完全分解吸收的热量为Q2kJ× ![]() =4Q2kJ,反应热化学方程式为:2C(g)A(g)+3B(g),△H=+4Q2kJ/mol,D不符合题意;
=4Q2kJ,反应热化学方程式为:2C(g)A(g)+3B(g),△H=+4Q2kJ/mol,D不符合题意;
所以答案是:B
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
Ⅰ.配制100mL 0.10mol/L NaOH标准溶液.
Ⅱ.取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如表.
实验编号 | NaOH溶液的浓度(mol/L) | NaOH溶液的体积 | 待测盐酸溶液的体积(mL) |
① | 0.10 | 20.00 | |
② | 0.10 | 18.56 | 20.00 |
③ | 0.10 | 18.54 | 20.00 |
(1)第1次实验滴定前液面在0刻度,滴定后如图所示,则第一次实验滴定完用去NaOH溶液的体积记录为mL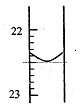
(2)根据上述数据,可计算出该盐酸的浓度为 .
(3)在上述实验中,下列操作会造成测定结果偏高的有
A.滴定终点时俯视读数
B.酸式滴定管使用前,水洗后未用待测稀盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液,定容时仰视
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
【题目】下图为实验室中某些气体的制备、除杂、收集装置。用此装置能获得干燥纯净气体的是
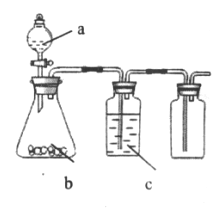
选项 | a | b | c | 气体 |
A | 浓盐酸 | Na2SO3 | 浓硫酸 | SO2 |
B | 稀硝酸 | Cu | 浓硫酸 | NO |
C | 浓盐酸 | MnO2 | 饱和食盐水 | Cl2 |
D | H2O2 | MnO2 | 浓硫酸 | O2 |
A. A B. B C. C D. D