��Ŀ����
����Ŀ���������[aFe2��SO4��3b��NH4��2SO4cH2O]�㷺���ڳ�����������ˮ����ҵѭ��ˮ�ľ��������ȣ�ij����������������������������ƣ��������Ϊԭ�ϣ��������ͼ����������ȡ������泥� 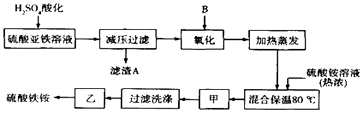
��ش��������⣺
��1������������Һ��H2SO4�ữ����ҪĿ����
��2���������������ʺϵ�������B�� ��
a��NaClO b��H2O2 c��KMnO4 d��K2Cr2O7
��3�������������ǣ��� ��
��4�����������У�����֮��ͼ�������֮ǰ����ȡ���������Լ��Ļ�ѧʽ������Fe2+�Ƿ���ȫ����������
��5����ȡ14.00g������Ʒ����������ˮ���Ƴ�100mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�2.14g����������һ����Һ�м���0.05mol Ba ��NO3��2��Һ��ǡ����ȫ��Ӧ�����������淋Ļ�ѧʽΪ ��
���𰸡�
��1��������Һ��SO42��Ũ�ȣ���Ca2+ת��Ϊ����ͬʱ����Fe2+ˮ��
��2��b
��3����ȴ�ᾧ
��4������������軯����Һ��������ɫ��������˵��������������
��5��Fe2��SO4��3?2��NH4��2SO4?2H2O
���������⣺��1���������ᣬ��������Һ��SO42��Ũ�ȣ���Ca2+ת��Ϊ����������CaSO4 �� ͬʱ����Fe2+ˮ�⣬
���Դ��ǣ�������Һ��SO42��Ũ�ȣ���Ca2+ת��Ϊ����ͬʱ����Fe2+ˮ�⣻��2��Ϊ�������������ʣ�Ӧ�����������Ϊ����������ԭ������ˮ��
��ѡb����3����80���·�Ӧ������������泥�������Ũ������ȴ�ᾧ������ϴ�ӣ����Բ�����Ϊ��ȴ�ᾧ��
���Դ��ǣ���ȴ�ᾧ����4�����������У�����֮��ͼ�������֮ǰ����ֹ������ˮ�⣬����Ҫ�����������ᣬ����Fe2+�Ƿ���ȫ���������ķ����ǣ�����Һ�м������軯����Һ��������ɫ��������˵�������������ӣ�
���Դ��ǣ�������������軯����Һ��������ɫ��������˵�������������ӣ���5����ȡ14.00g��Ʒ����������ˮ���ó�100mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�2.14g������ӦΪFe��OH��3 ��
n��Fe��OH��3��= ![]() =0.02mol��
=0.02mol��
����һ����Һ�м���0.05mol Ba��NO3��2��Һ��ǡ����ȫ��Ӧ����n��SO42����=0.05mol��
����14.00g��Ʒ�к���Fe2��SO4��30.02mol��n��SO42����Ϊ0.1mol����NH4��2SO4Ϊ0.1mol��0.02mol��3=0.04mol��
��m��H2O��=14.00g��0.02mol��400g/mol��0.04mol��132g/mol=0.72g��
n��H2O��= ![]() =0.04mol��
=0.04mol��
n��Fe2��SO4��3����n����NH4��2SO4����n��H2O��=0.02��0.04��0.04=1��2��2��
���Ի�ѧʽΪFe2��SO4��32��NH4��2SO42H2O��
���Դ��ǣ�Fe2��SO4��32��NH4��2SO42H2O��

 �ƸԾ���Ȥζ����ϵ�д�
�ƸԾ���Ȥζ����ϵ�д� ����С����ҵ��ϵ�д�
����С����ҵ��ϵ�д�