题目内容
【题目】氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.
(1)硫酸铜溶液时白磷引起中毒的一种解毒剂:
P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4 , 若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 .
(2)氮的化合物合成、应用及氮的固定一直是科学研究的热点.以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=﹣159.47kJmol﹣1
②NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);△H=a kJmol﹣1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=﹣86.98kJmol﹣1
则a为 .
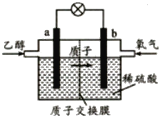
(3)如图表示使用新型电极材料,以N2、H2为电极反应物,以HCl﹣NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池.请写出该电池的正极反应式 . 生产中可分离出的物质A的化学式为 . 
(4)常温下,向0.1mol/L氨水中加入少许N2O5 , 使溶液中c(NH3H2O):c(NH4+)=5:9,此时溶液的pH= . (25℃时,NH3H2O的电离常数Kb=1.8×10﹣5)
(5)SiO2溶于氢氟酸后生成一种极强的二元酸和水,经分析该酸由3种元素组成,其中氟严肃的质量分数为79.17%.请写出SiO2溶于氢氟酸的离子方程式
【答案】
(1)0.75mol
(2)+72.49
(3)N2+6e﹣+8H+=2NH4+;NH4Cl
(4)9
(5)SiO2+6HF=2H++SiF62﹣+2H2O
【解析】解:(1)Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4中部分磷元素由0价降低到﹣3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若6molH3PO4生成,则参加反应CuSO4为6mol× ![]() =15mol,根据电子转移守恒,被CuSO4氧化的P4的物质的量为
=15mol,根据电子转移守恒,被CuSO4氧化的P4的物质的量为 ![]() =0.75mol,
=0.75mol,
所以答案是:0.75mol;(2)①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=﹣159.47kJmol﹣1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=a kJmol﹣1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=﹣86.98kJmol﹣1
依据热化学方程式和盖斯定律①+②=③,得到﹣159.47KJ/mol+a=﹣86.98KJ/mol
a=+72.49KJ/mol;
所以答案是:+72.49;(3)以N2、H2为原料,以HCl﹣NH4Cl为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+ , 电极反应式为N2+6e﹣+8H+=2NH4+;负极是氢气失电子生成氢离子,政绩生成铵根离子在电解质溶液中可以分离出氯化铵;
所以答案是:N2+6e﹣+8H+=2NH4+; NH4Cl;(4)常温下,向0.1mol/L氨水中加入少许N2O5 , 五氧化二氮和0.1水反应生成硝酸,硝酸和氨水反应,溶液中c(NH3H2O):c(NH4+)=5:9,溶液中溶质为硝酸铵和一水合氨,NH3H2ONH4++OH﹣ , 25℃时.NH3H2O的电离平衡常数Kb=1.8×10﹣5= 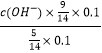 ,c(OH﹣)=10﹣5mol/L,c(H+)=10﹣9mol/L,PH=9,
,c(OH﹣)=10﹣5mol/L,c(H+)=10﹣9mol/L,PH=9,
所以答案是:9;(5)SiO2溶于氢氟酸后生成一种极强的二元酸和水,该酸由3种元素组成,其中氟元素的质量分数为79.17%,分子中H原子数目为2,令该酸的化学式为:H2SixFy , 根据化合价代数和为0可知2+4x﹣y=0,由氟元素质量分数有 ![]() ×100%=79.17%,联立解得x=1,y=6,故该酸为H2SiF6 , 故SiO2溶于氢氟酸的离子反应方程式为:SiO2+6HF=2H++SiF62﹣+2H2O,所以答案是:SiO2+6HF=2H++SiF62﹣+2H2O.
×100%=79.17%,联立解得x=1,y=6,故该酸为H2SiF6 , 故SiO2溶于氢氟酸的离子反应方程式为:SiO2+6HF=2H++SiF62﹣+2H2O,所以答案是:SiO2+6HF=2H++SiF62﹣+2H2O.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积v的数据,根据数据绘制得到下图,则曲线a所对应的实验组别是( ) 
组别 | c(HCl)(molL﹣1) | 温度(℃) | 状态 |
A | 2.0 | 25 | 块状 |
B | 2.5 | 30 | 块状 |
C | 2.5 | 50 | 粉末状 |
D | 2.5 | 50 | 块状 |
A.A
B.B
C.C
D.D