题目内容
【题目】在银锌原电池中,以硫酸铜溶液为电解质溶液。
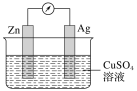
(1)锌为____极,电极上发生的是____(填“氧化”或“还原”)反应。电极反应式为____,锌片上观察到的现象为________。
(2)银为________极,电极上发生的是_____(填“氧化”或“还原”)反应,电极反应式是________,银片上观察到的现象是________。
(3)该电池中,每有2mol电子流过导线,负极___(填“减少”或“增加”)___g,正极____(填“减少”或“增加”)________g。
【答案】负 氧化 Zn-2e-=Zn2+ 锌片逐渐溶解 正 还原 Cu2++2e-=Cu 银片上有红色物质析出 减少 65 增加 64
【解析】
在银锌原电池中,以硫酸铜溶液为电解质溶液,由金属活泼性Zn>Ag可知,Zn作原电池负极,Ag作原电池正极,负极反应电极反应式为:Zn-2e-=Zn2+,正极反应电极反应式为:Cu2++2e-=Cu,据此解答本题。
(1)由上述分析可知,Zn为负极;电极上发生氧化反应;电极反应式为:Zn-2e-=Zn2+;金属Zn逐渐反应,因此现象为锌片逐渐溶解,
故答案为:负;氧化;Zn-2e-=Zn2+;锌片逐渐溶解;
(2)Ag作原电池正极;电极上发生还原反应;电极反应式为:Cu2++2e-=Cu;银片上有铜单质的析出,可观察到的现象是银片上有红色物质析出,
故答案为:正;还原;Cu2++2e-=Cu;银片上有红色物质析出;
(3)由电极反应式可知,当有2mol电子流过导线,负极则有1molZn被溶解,即负极材料减小65g/mol×1mol=65g;正极上有1molCu析出,即正极增加64g/mol×1mol=64g,
故答案为:减少;65;增加;64。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目