题目内容
【题目】Ⅰ.如下图所示是实验中常用的几种仪器:
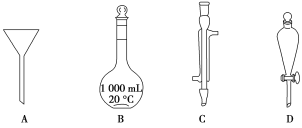
写出各字母所代表的仪器的名称:A________;B________;C________;D________。
Ⅱ.实验室要配制500 mL 0.2 mol/L NaOH溶液,请回答下列问题:
(1)配制过程中不需要使用的化学仪器有________(填字母)。
A.烧杯
B.500 mL容量瓶
C.漏斗
D.胶头滴管
E.玻璃棒
(2)用托盘天平称取氢氧化钠,其质量为________ g。
(3)下列主要操作步骤的正确顺序是________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶瓶颈刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到500 mL容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度________(填“偏高”“偏低”或“不变”)。
【答案】漏斗容量瓶冷凝管分液漏斗C4.0①③⑤②④偏低
【解析】
Ⅰ.由图示可知各仪器的名称为:A. 漏斗 B. 容量瓶C. 冷凝管D. 分液漏斗Ⅱ.(1)配制溶液肯定用到容量瓶。溶解氢氧化钠用到烧杯,搅拌、转移溶液用到玻璃棒,定容用到胶头滴管,故答案为:C;(2)氢氧化钠的质量为0.5 L×0.2 mol/L×40 g/mol=4.0 g,托盘天平可读到小数点后一位,故答案为: 4.0 g (3)配制溶液的基本步骤为计算、称量、溶解、冷却转移、洗涤、定容、摇匀,故答案为:①③⑤②④,(4)如果实验过程中缺少步骤⑤,则所配制的溶液中溶质的质量减少,故溶液的浓度偏低,故答案为:偏低。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目