题目内容
(12分)硫酸锌被广泛应用于工农业生产和医药领域。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的一种流程如下:
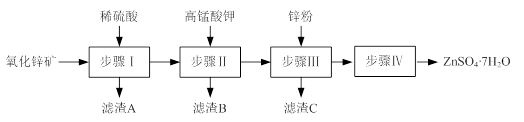
⑴步骤Ⅰ包括酸浸和过滤两个操作。
①酸浸时,需不断通入高温水蒸气的目的是 。
②过滤时,为防止堵塞,过滤装置需经常用氢氧化钠溶液清洗,其清洗原理是
(用化学方程式表示)。
⑵步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为 。
⑶步骤Ⅲ所得滤渣C的主要成分是 。
⑷取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。
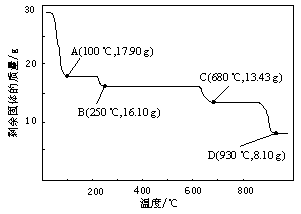
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是 。
②680 ℃时所得固体的化学式为 。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O

⑴步骤Ⅰ包括酸浸和过滤两个操作。
①酸浸时,需不断通入高温水蒸气的目的是 。
②过滤时,为防止堵塞,过滤装置需经常用氢氧化钠溶液清洗,其清洗原理是
(用化学方程式表示)。
⑵步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为 。
⑶步骤Ⅲ所得滤渣C的主要成分是 。
⑷取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。

①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是 。
②680 ℃时所得固体的化学式为 。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
⑴①升高温度、使反应物充分混合,以加快反应速率
②H2SiO3+2NaOH=Na2SiO3+2H2O
⑵3Fe2++MnO4—+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+
⑶Cu(Zn)
⑷①降低烘干的温度,防止ZnSO4·7H2O分解 ②b (每空2分,共12分)
②H2SiO3+2NaOH=Na2SiO3+2H2O
⑵3Fe2++MnO4—+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+
⑶Cu(Zn)
⑷①降低烘干的温度,防止ZnSO4·7H2O分解 ②b (每空2分,共12分)
试题分析:⑴①酸浸时,不断通入高温水蒸气可使反应液的温度升高,使反应物充分混合,以加快反应速率。
②用氢氧化钠溶液清洗过滤装置,目的是使反应生成的H2SiO3滤渣反应生成Na2SiO3溶解除去。
⑵根据题意首先满足得失电子守恒有3Fe2++MnO4—――3Fe(OH)3↓+MnO(OH)2↓,满足电荷守恒有3Fe2++MnO4—――3Fe(OH)3↓+MnO(OH)2↓+5H+(溶液pH约为5.1),最后满足原子守恒得3Fe2++MnO4—+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+。
⑶步骤Ⅲ:向含有Cu2+、Zn2+、SO42-的滤液中加入锌粉,置换出铜,可能含有过量的锌粉。
⑷①由于ZnSO4·7H2O易分解,烘干时要适当降低温度。
②28.70 g ZnSO4·7H2O的物质的量为0.1mol,若得ZnSO4·H2O的质量为17.90g(100℃);若得ZnSO4的质量为16.10g(250℃);若得ZnO的质量为8.10g(930℃);据此通过排除法确定680 ℃时所得固体的化学式为Zn3O(SO4)2。

练习册系列答案
相关题目
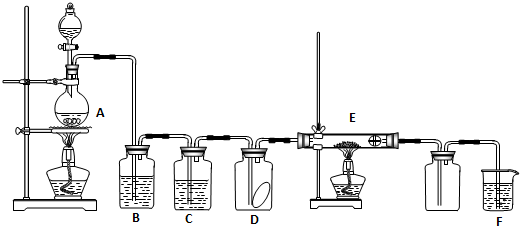
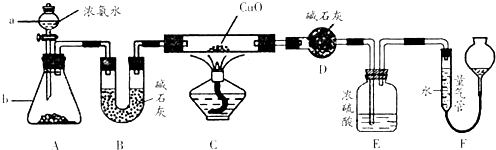
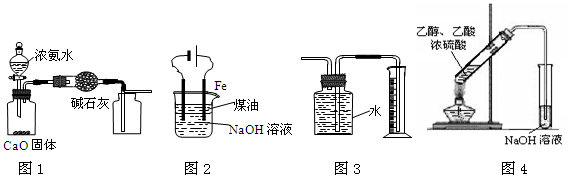

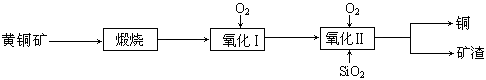
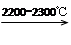 CaC2+CO
CaC2+CO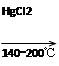 CH2=CHCl
CH2=CHCl