题目内容
关于如图所示①、②两个装置的评价正确的是
| 选择 | 叙 述 | 评价 |
| A | 装置名称:①电解池,②原电池 | 错误 |
| B | 硫酸浓度变化:①增大,②减小 | 错误 |
| C | 电极反应式:①阳极:4OH--4e-====2H2O+O2↑ ②正极:Zn-2e-====Zn2+ | 正确 |
| D | 离子移动方向:①H+向阴极移动 ②H+向正极移动 | 正确 |
D
解析试题分析:A、装置①外加了电源,为电解池,装置②形成Zn、Cu原电池,叙述正确;B、电解稀硫酸实质是电解水,所以装置①中硫酸浓度增大,装置②的总反应为:Zn+H2SO4=ZnSO4+H2↑,硫酸浓度减小,叙述正确;C、电解硫酸溶液的阳极为OH?失电子:4OH--4e-=2H2O+O2↑,原电池的正极为H+得电子:2H++2e?=H2↑,叙述错误;D、电解池电解质溶液中阳离子向阴极移动,原电池电解质溶液中阳离子向正极移动,正确。
考点:本题考查电解池和原电池原理及应用。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列关于写图所示原电池的叙述中,正确的是
| A.质量减轻的一极是铜极 |
| B.负极反应为Fe—2e→ Fe2+ |
| C.该装置将电能转变为化学能 |
| D.电流由负极经导线流向正极 |
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述正确的是( )
| A.放电时,负极反应式为3Zn-6e-+6OH-===3Zn(OH)2 |
| B.放电时,正极区溶液的pH减小 |
| C.充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
| D.充电时,电池的锌电极接电源的正极 |
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是 
| A.Mg电极是该电池的正极 | B.H2O2在石墨电极上发生氧化反应 |
| C.石墨电极附近溶液的pH增大 | D.溶液中Cl-向正极移动 |
已知:锂离子电池的总反应为:LixC+Li1-xCoO2 C+LiCoO2锂硫电池的总反应为:2Li+S
C+LiCoO2锂硫电池的总反应为:2Li+S Li2S
Li2S
有关上述两种电池说法正确的是
| A.锂离子电池放电时,Li+向负极迁移 |
| B.锂硫电池充电时,锂电极发生还原反应 |
| C.理论上两种电池的比能量相同 |
| D.右图表示用锂离子电池给锂硫电池充电 |
如图所示是利用电化学降解法治理水中的硝酸盐污染,电解槽中间用质子交换膜隔开,污水放入II区,通电使转NO3-化为N2,下面说法不正确的是 ( )
| A.电解时H+从I区通过离子交换膜迁移到II区 |
| B.Ag-Pt电极上发生发应:2 NO3-+10e-+6H2O= N2↑+12OH- |
| C.当电解过程中转移了1moL电子,则II区电解液质量减少2.8g |
| D.为增强溶液的导电性,I区水中可加入少量Na2SO4固体 |
以Fe为阳极,Pt为阴极,对足量的 Na2SO4 溶液进行电解,一段时间后得到4 mol Fe(OH)3沉淀,此间共消耗水的物质的量为 ( )
| A.6mol | B.8mol | C.10mol | D.12mol |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是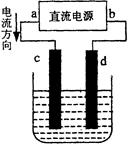
| A.a为负极、b为正极 | B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 | D.电解过程中,氯离子浓度不变 |